- Алкены — что это в химии, общая формула
- Получение и применение алкенов
- Реакции присоединения
- Присоединение галогенводородов
- Правило Марковникова
- Галогенирование
- Гидрирование
- Гидратация
- Что мы узнали?
- Окисление
- Окисление перманганатом калия
- Как образуются наименования олефинов
- Что такое алкины
- Названия алканов и их характеристика
- Номенклатура
- Строение молекул
- Полимеризация
- Радикальная полимеризация
- Ионная полимеризация
- Распространённые полимеры
- Реакции
- Структура, изомерия, реакционная способность
- Гомологический ряд этена
- Что такое алканы
- Физические и химические свойства алкенов
Алкены — что это в химии, общая формула
Определение
Алкены (олефины, этиленовые углеводороды) представляют собой ненасыщенные ациклические углеводороды, которые включают одинарную двойную связь между атомами углерода.
Формула
Общая формула гомологического ряда алкенов:
CnH2n
Атомы углерода, образующие двойную связь, характеризуются состоянием гибридизации sp2, валентный угол составляет 120 °. Простейшим представителем алкеновой группы является этилен (C2H4).
Согласно правилам ИЮПАК, алкены получают названия путем замены суффикса «-ан» в соответствующем алкане суффиксом «-ен». В конце названия номер атома углерода, за которым следует двойная связь, указывается арабскими цифрами, разделенными тире.
Углеводородные радикалы, содержащие двойные связи, обозначаются добавлением суффикса «-il» к соответствующему алкену. Примеры тривиальных названий ненасыщенных заместителей: CH2 = CH — «винил», CH_ {2} = CH — CH_ {2} — «аллил».
Получение и применение алкенов
Основным промышленным источником алкенов является природный газ, нефть и продукты их переработки (например, продукты крекинга).
Основной метод получения алкенов — реакция элиминирования. В этом случае атом или группа отделяются от двух соседних атомов углерода:

В лаборатории алкены можно получить в результате реакции дегидратации (удаления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:

Упражнение 19.4. Какую молекулу нужно отделить от хлорэтана, чтобы получить алкен?
Решение. Сравним состав хлорэтана и этилена:

Эта реакция происходит под действием щелочного спиртового раствора. Уравнение этого процесса записывается следующим образом:

Запрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана, чтобы получить этилен?
Алкены легко вступают в химические реакции, поэтому их используют для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задача 19.7. Составьте уравнения реакций получения перечисленных веществ.
Полиэтиленовые пленки широко используются не только для консервирования пищевых продуктов: ими закрывают дно каналов с целью уменьшения потерь влаги; полиэтиленовая пленка используется для строительства теплиц; он оборачивается вокруг труб, чтобы уменьшить потери из-за коррозии и т д

Реакции присоединения
Присоединение галогенводородов
Галогениды водорода легко присоединяются к двойной связи алкенов, образуя галогеналкилы. Галогенводород смешивают с уксусной кислотой или непосредственно в газообразном состоянии с алкеном. Чтобы рассмотреть механизм реакции, нужно знать правило Марковникова.
Правило Марковникова
Когда гомологи этилена реагируют с кислотами, водород присоединяется к более гидрогенизированному атому углерода.
Исключение из правила — гидроборирование алкинов — будет рассмотрено в статье, посвященной алкинам.
Механизм реакции присоединения галогенидов к алкенам следующий: в молекуле галогенида водорода происходит разрыв гомолитической связи, образуются протон и анион галогена. Протон присоединяется к алкену с образованием карбокатиона, эта реакция является эндотермической и имеет высокий уровень энергии активации, поэтому реакция протекает медленно. Образовавшийся карбокатион очень реакционноспособен, поэтому он легко связывается с галогеном, энергия активации мала, поэтому эта стадия не тормозит реакцию.
Галогенирование
При комнатной температуре алкены реагируют с хлором и бромом в присутствии четыреххлористого углерода. Механизм реакции присоединения галогена следующий: электроны связи действуют на молекулу галогена X2. Когда галоген приближается к олефину, электроны в молекуле галогена перемещаются к более удаленному атому, поэтому молекула галогена поляризована, ближайший атом имеет положительный заряд, а более удаленный — отрицательный. В молекуле галогена происходит разрыв гетеролитической связи и образуются катион и анион. Катион галогена присоединен к двум атомам углерода через электронную пару связи и свободную электронную пару катиона. Оставшийся анион галогена действует на один из атомов углерода в молекуле галогеналкена, прерывая цикл CCX и образуя диалоалкен.
Реакции присоединения алкенов имеют два основных применения, первое — это количественный анализ, определение количества двойных связей по количеству поглощенных молекул X2. Второй — в промышленности. Производство пластика основано на винилхлориде. Трихлорэтилен и тетрахлорэтилен — отличные растворители жиров и ацетиленовых каучуков.
Гидрирование
Добавление газообразного водорода к алкену происходит с катализаторами Pt, Pd или Ni. В результате реакции образуются алканы. Основное применение реакции каталитического присоединения водорода — это, прежде всего, количественный анализ. Остальные молекулы H2 можно использовать для определения количества двойных связей в веществе. Во-вторых, растительные и рыбные жиры являются ненасыщенными углеводородами, и такое гидрирование приводит к повышению температуры плавления, превращая их в твердые жиры. На этом процессе основано производство маргарина.
Гидратация
Когда алкены смешивают с серной кислотой, образуются гидросульфаты алкила. При разбавлении алкилгидросульфатов водой и одновременном нагревании образуется спирт. Примером реакции является смешивание этена (этилена) с серной кислотой с последующим смешиванием с водой и нагреванием, в результате получается этанол.
Что мы узнали?
Из темы урока мы узнали, что такое алкены. Это класс органических веществ, содержащих двойную связь между атомами углерода. Алкены называются добавлением суффикса «-en». В зависимости от количества атомов углерода алкены могут находиться в газообразном, жидком или твердом состоянии. Алкены в природе производятся искусственным путем, вещества практически не встречаются. Это активные соединения, вступающие в реакцию с неорганическими веществами.
Окисление
Алкены легко окисляются различными веществами, такими как KMnO4, O3, OsO4 и др. существует два типа окисления алкенов: разрыв связи без разрыва связи и разрыв связи — е-связи. Окисление без разрыва сигма-связи называется мягким окислением, а разрыв сигма-связи — жестким окислением.
Окисление этена без разрыва связи приводит к образованию эпоксидов (эпоксиды — это циклические соединения ССО) или двухатомных спиртов. Окисление с разрывом связи образует ацетон, альдегиды и карбоновые кислоты.
Окисление перманганатом калия
Реакции окисления алкенов под действием перманганата калия называются открытыми Егором Вагнером и носят его имя. В реакции Вагнера окисление происходит в органическом растворителе (ацетоне или этаноле) при температуре 0-10 ° C, в слабом растворе перманганата калия. В результате реакции образуются двухатомные спирты, а перманганат калия обесцвечивается.
Как образуются наименования олефинов
Согласно систематической номенклатуре формулы алкенов и их названия происходят от строения алканов, относящихся к насыщенным углеводородам. Для этого в названии последнего суффикс -an заменяется на -ilen или -en. Примером может служить образование бутилена из бутана и пентена из пентана.
Чтобы указать положение двойной связи относительно атомов углерода, укажите арабское число в конце названия.
Название алкенов основано на обозначении углеводорода с самой длинной цепью, в которой присутствует двойная связь. Для начала нумерации цепей обычно выбирают конец, наиболее близкий к ненасыщенному соединению атомов углерода.
Если структурная формула алкенов имеет разветвления, то указываются названия радикалов и ставятся перед ними их количество и соответствующие числа в углеродной цепи. Далее следует название самого углеводорода. После цифр обычно ставится дефис.
Есть ненасыщенные радикальные ответвления. Их названия могут быть банальными или образованными по правилам систематической номенклатуры.
Например, HNC = CH- обозначается как этенил или винил.
Что такое алкины
Их также называют ацетиленовыми углеводородами, которые имеют тройную связь в углеродной цепи. Строение алкинов описывается общей формулой CnH2n — 2. Она показывает, что в отличие от алканов в ацетиленовых углеводородах отсутствуют четыре атома водорода. Их заменяет тройная связь, образованная двумя соединениями.
Эта структура определяет химические свойства этого класса. Структурная формула алкенов и алкинов ясно показывает ненасыщенность их молекул, а также наличие двойных (H2C꞊CH2) и тройных (HC≡CH) связей.
Названия алканов и их характеристика
Самый простой представитель этого класса — метан. За ним следуют такие вещества, как этан, пропан и бутан. Их название происходит от корня числа в греческом языке, к которому добавлен суффикс -an. Названия алканов перечислены в номенклатуре ИЮПАК.
Общая формула алкенов, алкинов, алканов включает только два типа атомов. К ним относятся элементы углерод и водород. Число атомов углерода во всех трех классах одинаково, разница наблюдается только в количестве водорода, который может быть разделен или присоединен. Ненасыщенные соединения получают из насыщенных углеводородов. Представители парафинов в своей молекуле содержат на 2 атома водорода больше, чем олефины, что подтверждается общей формулой алканов, алкенов. Структура алкенов считается ненасыщенной из-за наличия двойной связи.
Если соотнести количество атомов водорода и углерода в алканах, значение будет максимальным по сравнению с другими классами углеводородов.
От метана до бутана (от C1 до C4) вещества существуют в газообразной форме.
Углеводороды гомологического диапазона от C5 до C16 находятся в жидкой форме. Начиная с алкана, который имеет 17 атомов углерода в основной цепи, происходит переход физического состояния в твердую форму.
Для них характерна изомерия углеродного скелета и оптические модификации молекулы.

В парафинах считается, что валентности углерода полностью заняты соседними атомами углерода или атомами водорода с образованием типовой связи. С химической точки зрения это определяет их слабые свойства, поэтому алканы называют насыщенными или насыщенными углеводородами, не имеющими сродства.
Они вступают в реакции замещения, связанные с радикальным галогенированием, сульфохлорированием или нитрованием молекулы.
Парафины подвергаются окислению, горению или разложению при высоких температурах. Под действием ускорителей реакций происходит отщепление атомов водорода или дегидрирование алканов.
Номенклатура
Названия алкенов в гомологическом ряду соответствуют названиям алканов, но суффикс «-ан» заменен на «-ен». Названия и формулы веществ приведены в таблице алкенов.
| Имя | Формула |
| Этен (этилен) | C2H4 |
| Пропен (пропилен) | C3H6 |
| Бутен (бутилен) | C4H8 |
| Penten | C5H10 |
| Esene | C6H12 |
| Hepten | C7H14 |
| Octen | C8H16 |
| Никто | C9H18 |
| Decene | C10H20 |
Имя может состоять из двух цифр. В начале названия цифра указывает положение заместителей (в формуле это записано в скобках). Вторая цифра в конце имени указывает положение двойной связи. Нумерация атомов начинается с конца, к которому ближе всего двойная связь. Например, название «5-метилгексен-2» указывает на то, что метил присоединен к пятому атому гексена, а двойная связь находится между вторым и третьим атомами.
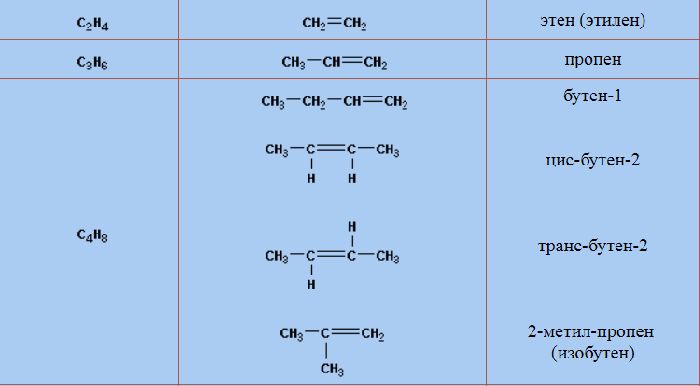
Рис. 2. Примеры написания структурных формул алкенов.
Алкены, помимо этилена, имеют изомеры. Для пропилена характерна межклассовая изомерия. Его единственный изомер — циклопропан (C3H6). Изменения углеродного скелета и положения двойной связи, а также структурная изомерия характерны для веществ, начинающихся с бутилена (бутен-1, бутен-2, изобутилен, цис-бутен-2, транс-бутен-2).
Строение молекул
Молекулы алкенов отличаются по структуре от молекул алканов тем, что содержат двойную связь. Рассмотрим структуру этой связи. Эта связь ковалентна, но неоднородна. Одна из двух связей имеет ту же природу, что и связь в молекулах алкана, то есть это сильная связь. Другая связь двойной связи образована иначе, она менее прочная и обозначается буквой (пи). Это связь. Следовательно, молекула этена (этилена) содержит:

Запрос. Какую связь будет легче разорвать в химических реакциях: связь или?
В результате алкены (и любые другие углеводороды), которые легко связываются, иногда даже при нормальных условиях, вступают в химические реакции, и эти реакции происходят из-за разрыва связи.
Полимеризация
Большинство простых алкенов могут вступать в реакции самоприкрепления, образуя большие молекулы из структурных единиц. Такие большие молекулы называются полимерами, а реакция, производимая полимером, называется полимеризацией. Простые структурные единицы, образующие полимеры, называются мономерами. Полимер обозначается заключением в скобки повторяющейся группы с индексом «n», что означает большое количество повторов, например: «- (CH2-CH2) n-» — полиэтилен. Процессы полимеризации составляют основу производства пластмасс и волокон.
Радикальная полимеризация
Свободнорадикальная полимеризация инициируется катализатором, например кислородом или пероксидом. Реакция состоит из трех фаз:
Посвящение
ROOR → 2RO•
CH2 = CH-C6H5 → RO-CH2C • H-C6H5
Рост сети
RO-CH2C • H-C6H5 + CH2 = CH-C6H5 → RO-CH2-CH (C6H5) -CH2-C • -C5H6
Разорвать цепочку путем рекомбинации
CH2-C • H-DO6H5 + CH2-C • H-DO6H5 → CH2-CH-C6H5-CH2-CH-DO6H5
Обрыв цепи из-за диспропорции
CH2-C • H-DO6H5 + CH2-C • H-DO6H5 → CH = DO-C6H5 + CH2-CH2-C6H5
Ионная полимеризация
Другой метод полимеризации алкенов — ионная полимеризация. Эта реакция протекает с образованием интермедиатов — карбокатионов и карбанионов. Образование первого карбокатиона, как правило, осуществляется с помощью кислоты Льюиса; образование карбаниона происходит, соответственно, по реакции с основанием Льюиса.
A + CH2 = CH-X → A-CH2-C + HX →… → A-CH2-CHX-CH2-CHX-CH2C + HX…
B + CH2 = CH-X → B-CH2-CHX →… → B-CH2-CHX-CH2-CHX-CH2C-HX…
Распространённые полимеры
Наиболее распространены полимеры:
МономерФормулаПолимер
| Ethen | H2C = CH2 | Полиэтилен |
| Хлорэтилен (винилхлорид) | H2C = CHCl | Поливинилхлорид (ПВХ) |
| Фенилэтен | F2C = CF2 | Тефлон |
| Пропеннитрил (полиакрилонитрил) | H2C = CH-C≡N | Нитрон |
| Метилметакрилат | СН2 = С (СН3) -СООСН3 | Оргстекло |
| Таблица 1. Обычные полимеры |
Реакции
Характерными реакциями алкенов являются реакции присоединения, связь разрывается, и образующиеся электроны с радостью принимают новый элемент. Наличие связи означает больше энергии, поэтому, как правило, реакции присоединения экзотермичны, т.е протекают с выделением тепла.
Структура, изомерия, реакционная способность
Алкены с более чем двумя атомами углерода (т.е исключая этилен) имеют изомеры. Для алкенов характерны следующие типы изомерии:
- углеродный скелет;
- позиции двойной связи;
- межклассный;
- геометрический.
Примером является пропилен, единственный изомер которого представлен циклопропаном (C3H6), т.е пропен характеризуется только межклассовой изомерией. Исходя из бутилена, появляются изомеры с двойной связью (бутен-1 и бутен-2), изомеры углеродного скелета (изобутилен или метилпропилен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С увеличением количества атомов углерода в молекуле количество изомеров увеличивается экспоненциально.
Многие представители алкенов могут существовать в виде различных пространственных или геометрических изомеров. Геометрические изомеры бывают следующих типов:
- цис-изомеры, в которых заместители находятся на одной стороне относительно плоскости двойной связи;
- транс-изомеры, заместители расположены по разные стороны от плоскости двойной связи.
Согласно правилам IUPAC существует следующая номенклатура геометрических изомеров:
- Z-изомеры, где основные заместители у атомов углерода двойной связи находятся на той же стороне, что и двойная связь.
- Е-изомеры, в которых старшие заместители у атомов углерода двойной связи находятся на разных сторонах, чем двойная связь.
Согласно теории гибридизации, двойная связь образована перекрытием вдоль линии связи гибридных орбиталей C-Csp2 атомов углерода (связь) и боковым перекрытием р-орбиталей углерода (связь).
При sp2-гибридизации атом углерода характеризуется возбужденным электронным состоянием
В молекуле этилена все атомы находятся в одной плоскости. В этом случае валентный угол составляет около 120 °. Центры атомов углерода в этилене удалены друг от друга на 0,134 нм (длина двойной связи). Следовательно, двойная связь короче одинарной CC, длина которой составляет 0,154 нм.
Согласно теории молекулярных орбиталей, за счет линейной комбинации пары 2p-атомных орбиталей углерода образуется пара молекулярных π-орбиталей этилена
Гомологический ряд этена
Неразветвленные алкены образуют гомологичный ряд этена (этилена): C2H4 — этен, C3H6 — пропен, C4H8 — бутен, C5H10 — пентен, C6H12 — гексен, C7H14 — гептен и т.д.
Что такое алканы
Их еще называют парафинами или насыщенными ациклическими углеводородами. Они имеют линейную или разветвленную структуру, содержащую только насыщенные простые связи. Все представители гомологических рядов этого класса имеют общую формулу CnH2n + 2.

Они содержат только атомы углерода и водорода. Общая формула алкенов происходит от обозначения насыщенных углеводородов.
Физические и химические свойства алкенов
Физические свойства алкенов:
- повышение температур плавления и кипения веществ с увеличением молекулярной массы и длины основной углеродной цепи;
- в нормальных условиях присутствуют алкены от C2H4 до C4H8 в виде газообразных веществ; от пентена C5H10 до гептадецена C17H34 включительно они являются жидкими, начиная с октадецена C18H36 они существуют в твердом агрегатном состоянии;
- соединения не растворимы в воде;
- вещества отличаются хорошей растворимостью в органических растворителях.
Алкены химически активны. Химические свойства во многом определяются наличием двойной связи в молекулах алкенов.
Реакции
Галогенирование алкенов, которое происходит без специальных инициаторов радикальных реакций, является стандартной реакцией электрофильного присоединения:
R — CH = CH2 + Br2 → R — CHBr — CH2Br
Процесс электрофильного присоединения галогенидов водорода к алкенам протекает по правилу Марковникова: водород присоединяется к более гидрированному атому углерода (к атому углерода, с которым связано больше атомов водорода). Например, присоединение к HBr:
Если же процесс осуществляется в присутствии пероксидов ROOR, нарушается это правило, получившее название эффекта Хараша (в этих условиях преобладает радикальный механизм):
Галогены связываются с алкенами даже при комнатной температуре в растворе. Роль растворителей играет вода CCl4. Качественная реакция на двойную связь происходит при взаимодействии бромной воды с алкенами, в результате чего красно-коричневый раствор бромной воды теряет свой цвет.
Бромирование пропилена сопровождается образованием 1,2-дибромпропана, а хлорирование приводит к получению 1,2-дихлорпропана:
Реакции
Общее гидрирование алкенов
R — CH = CH — R ‘+ H2 → R — CH2 — CH2 — R’
Для гидрирования алкенов водородом требуется катализатор. В роли гетерогенных катализаторов гидрирования выступают металлы, способные поглощать водород:
- платина;
- палладий;
- никель.
Образование бутана при гидрировании бутена-2:
Алкены способны атаковать галогениды водорода. Процесс протекает по механизму электрофильного присоединения, которое сопровождается образованием галогенированного алкана.
Образование бромэтана при реакции этилена с бромистоводородной кислотой:

Реакции
Реакция гидратации алкенов, протекающая по правилу Марковникова, протекает, например, в процессе добавления воды к алкенам в присутствии серной кислоты:
R — CH = CH2 + H2O → R — CH (OH) — CH3
Алкены претерпевают реакции полимеризации. В этом случае процесс протекает по свободнорадикальному или ионному механизму.
Реакции
Реакция полимеризации алкенов по свободнорадикальному механизму позволяет получить полиэтилен высокого давления:
n CH2 = CH2 → — — CH2 — CH2 — n-
Пероксиды играют роль катализаторов в этой реакции. В случае, если полимеризация осуществляется по ионному механизму, в качестве катализаторов используются кислоты (катионная полимеризация), металлоорганические соединения (катализаторы Циглера-Натта, анионная полимеризация).
Процесс окисления алкенов определяется условиями и типами окисляющих реагентов. В этом случае двойная связь разрывается, но углеродный скелет может быть сохранен.
Реакции
В случае создания мягких условий в результате окисления алкенов к двойной связи добавляются две гидроксильные группы:
R — CH = CH — R + OsO4 + 2H2O → R — CH (OH) — CH (OH) — R + OsO2 (OH) 2
На начальном этапе к алкену добавляется оксид осмия. На следующем этапе образовавшийся комплекс превращается в диол (реакция Криге) под действием восстановителя (Zn или NaHSO3).
Реакции
Аналогичным образом реакция протекает в нейтральной или слабощелочной среде под действием KMnO_ {4} при низкой температуре (5 ° C, реакция Вагнера):
3CH2 = CH2 + 2KMnO4 + 4H2O → 3CH2OH — CH2OH + 2KOH + 2MnO2
Реакции
Под действием сильных окислителей (KMnO4 или K2Cr2O7 в среде H2SO4) при нагревании разрывается двойная связь, продуктами в данном случае являются карбонильные соединения (карбоновые кислоты, кетоны):
R — CH = CH — R + O → 2R — COOH
R — CH = C (R) (R ‘) + O → R — COOH + R — C (O) — R’ (кетон)
Реакции
В том случае, если реакция окисления этена происходит в присутствии солей палладия, образуется ацетальдегид (процесс Ваккера):
2CH2 = CH2 + O2 → 2CH3CHO
Поскольку алкены являются углеводородами, они горят в атмосфере кислорода с образованием диоксида углерода и воды.
Реакции
Общая формула горения алкенов:
CnH2n + 3n / 2O2 → nCO2 + nH2O + Q
Q — тепло
Реакции
Сжигание пропилена:
2C3H6 + 9O2 → 6CO2 + 6H2O
Реакции
При высоких температурах (например, выше 400 ° C) обратимое добавление радикалов подавляется. Таким образом, становится возможным заменить атом водорода, который находится в аллильном положении (рядом с атомом углерода по двойной связи), и сохранить двойную связь:
CH3 — CH = CH2 + Cl2 → ClCH2 — CH = CH2 + HCl
Это радикальный процесс. Реакция проводится так же, как хлорирование алканов.
Если алкены нагревают в присутствии катализатора (Al2O3), реакция изомеризации протекает. При этом сдвигаются двойные связи или изменяется структура углеродного скелета. Изомеризация приводит к образованию более стабильных алкенов из менее стабильных. В обычных случаях двойная связь перемещается к центру молекулы (такие соединения более устойчивы).
Образование бутена-2 или 2-метилпропена во время изомеризации бутена-1:
СН2 = СН-СН2-СН3 → СН3-СН = СН-СН3
- https://wika.tutoronline.ru/himiya/class/9/vidy-alkenov-kakie-himicheskie-i-fizicheskie-svojstva-prisushhi
- https://himi4ka.ru/samouchitel-po-himii/urok-19-alkeny.html
- https://k-tree.ru/articles/himiya/organicheskaya_himiya/alkeny
- [https://obrazovaka.ru/himiya/alkeny.html]
- [https://FB.ru/article/239184/obschaya-formula-alkenov-svoystva-i-harakteristika-alkenov]
- [http://himege.ru/alkeny-nomenklatura-poluchenie-xarakternye-ximicheskie-svojstva/]
