- Описание процесса
- 5. Влияние режима электролиза на качество покрытия и выход по току.
- 5.1 Влияние состава электролита на свойства никелевых покрытий.
- 5.1.1 Блескообразователи в электролите никелирования.
- 5.1.2 Выравнивающе добавки.
- 5.1.3 Смачивающие добавки.
- 5.1.4 Электропроводящие добавки.
- 5.2 Влияние примесей в электролите на качество никелевого покрытия.
- 5.3 Влияние температуры и перемешивания электролита никелирования на качество покрытий.
- 5.4 Влияние рН электролита на качество покрытий.
- 5.5 Влияние плотности тока и его формы на качество покрытий.
- Главные внутренние факторы протекания электрохимической коррозии
- Текущее состояние поверхности металла
- Степень термодинамической стойкости металла
- Кристаллографическая структура
- Гетерогенность
- Основные внешние факторы электрохимической коррозии
- 3. Катодные процессы при электроосаждении.
- Основные объекты коррозии
- Отличия химической коррозии от электрохимической
- Современные методы борьбы
- 2. Электролиты для нанесения.
Описание процесса
Электрохимическая коррозия — это процесс, протекающий при обязательном наличии:
- электролит;
- металлы с низким и высоким окислительно-восстановительным потенциалом (электродные потенциалы).
Электролит состоит из воды, конденсата, любых естественных осадков. Наличие двух типов металла почти всегда не существует, и это связано с двумя факторами:
- Неоднородность продукта, т.е наличие посторонних включений.
- Непосредственно касаясь изделий из различных металлов.
В электролите неоднородные металлы образуют закороченный гальванический элемент, называемый коррозионным. Эта комбинация приводит к растворению металла с более низким электродным потенциалом, что называется электрохимической коррозией. Скорость этого процесса сильно зависит от наличия солей в растворе и его температуры.
5. Влияние режима электролиза на качество покрытия и выход по току.
На свойства никелевых покрытий сильно влияют:
-
- Состав ванной комнаты;
- Температура;
<li>pH;
- Плотность тока;
- Посторонние примеси.
5.1 Влияние состава электролита на свойства никелевых покрытий.
Все электролиты для никелирования делятся на следующие основные группы:
- Сульфат (ватт);
- Сульфамин;
- Фторборат;
- Хлористый;
- Кремнефтористоводородная кислота.
На практике чаще всего используются первые два. Остальные электролиты предназначены для получения непрозрачного никеля с высокой плотностью тока, с выходом по току 100% или для покрытия алюминиевых изделий непосредственно электролизом. Все они встречаются гораздо реже.
Как матовое, так и глянцевое покрытие можно получить из электролита Уоттса. В настоящее время полируется около 80% всех никелевых покрытий. Также возможно получение глянцевых покрытий из сульфаминового электролита с определенными добавками, но его чаще используют для получения матового пластичного никеля с низкими внутренними напряжениями путем гальванопластики или металлизации диэлектриков.
Введение в электролит осветляющих и выравнивающих добавок позволяет сразу получать гладкие и блестящие покрытия из ванной. Блестящее никелирование имеет ряд преимуществ перед матовым:
- исключается трудоемкая операция механической полировки;
- снижается расход металла, как это происходит при механической полировке углов, кромок и кромок;
- сокращается количество технологических операций и создаются условия для автоматизации всего технологического цикла;
- процесс осаждения интенсифицируется за счет использования более высоких плотностей тока.
Основными недостатками глянцевых покрытий по сравнению с матовыми покрытиями являются сильное насыщение водородом, наличие повышенных внутренних напряжений и большое количество примесей, ухудшающих механические свойства.
Эффективность тока в сульфатном электролите увеличивается с увеличением концентрации ионов никеля в электролите.
Рассмотрим подробнее влияние добавок в электролит никелирования. Все добавки к электролиту никелирования делятся на полирующие, антипиттинговые (смачивания), выравнивающие и электропроводящие. Они могут быть как органического, так и неорганического происхождения. Многие добавки сегодня не используются как устаревшие (фталимид, формалин, хлорамин B и др.).
5.1.1 Блескообразователи в электролите никелирования.
Согласно одной из принятых классификаций осветляющие добавки делятся на два класса:
- Слабые отбеливатели (класс I) позволяют получать глянцевые покрытия только на глянцевой поверхности, их блеск обратно пропорционален толщине. Они не влияют на катодную поляризацию. К ним относятся уротропин, сахарин, хлорамин B, динатриевая соль нафталин-1,5-дисульфоновой кислоты и другие.
- Сильные отбеливатели (II класс) способствуют получению блеска не только на глянцевой, но и на матовой поверхности, причем блеск не зависит от толщины покрытий. Они увеличивают катодную поляризацию и выравнивают микрорельеф, но ухудшают механические свойства отложений. К ним относятся кумарин, тиомочевина, 1,4-бутиндиол и другие.
было установлено, что отбеливатели второго класса, особенно имеющие двойные и тройные связи, обычно гидрируются во время электролиза и что сульфогруппы отбеливателей первого класса в конечном итоге восстанавливаются до сульфидов. Сульфид никеля, включенный в осадок, дезактивирует каталитические центры никеля, замедляет параллельную реакцию разряда иона водорода и процессы гидрирования отбеливателей и снижает водородное насыщение осадка. Этим объясняется полезное использование сильного и слабого ополаскивателя.
В настоящее время среди осветлителей чаще всего используются бутиндиол-сахариновые связи, поскольку их поведение более изучено и разработаны методы очистки электролита от продуктов разложения этих добавок.
5.1.2 Выравнивающе добавки.
Выравнивающие добавки, являясь поверхностно-активным веществом, блокируют выступающие части поверхности, поэтому осаждение происходит в микровпадинах. К выравнивающим добавкам относятся, например, НИБ-3. Некоторые сильные осветлители также обладают выравнивающим эффектом.
5.1.3 Смачивающие добавки.
Для никелирования характерно явление, называемое точечной коррозии. Пузырьки газообразного водорода задерживаются на поверхности катода, и дальнейшая разрядка никеля в этих местах становится невозможной. Никель начинает выделяться вокруг пузырьков (рис. 6). На покрытии появляются поры, и оно теряет свои защитные и декоративные свойства. Все вещества, повышающие поверхностное натяжение, способствуют прилипанию пузырьков к катоду. Сильное действие могут иметь гидроксиды и органические соединения, а также продукты их распада и даже пыль.
Смачивающие добавки помогают снизить поверхностное натяжение электролита, удалить грязь и пузырьки водорода с поверхности катода. Смачивающие добавки включают изоприлнафталинсульфоновую кислоту, лаурилсульфат натрия, очиститель Progress и др.
Следует отметить, что большинство смачивающих и осветляющих средств представляют собой сульфоновые соединения. При электроосаждении сульфамид никеля образуется в результате серии превращений. Содержание серы в осадках в большом количестве отрицательно сказывается на механических и коррозионных свойствах последних.
5.1.4 Электропроводящие добавки.
В основном, чтобы повысить электропроводность раствора и, соответственно, снизить напряжение на ванне и сэкономить электроэнергию, вводят неорганические соли. Чаще всего это сульфат натрия, калия или магния. Однако, как обсуждалось в разделе 2.6, эти добавки способствуют подщелачиванию слоя вблизи катода и ухудшают качество покрытия.
5.2 Влияние примесей в электролите на качество никелевого покрытия.
Никелевые отложения очень чувствительны к примесям, попадающим в электролит. Эти примеси подразделяются на неорганические и органические.
Неорганические примеси вызывают образование хрупких и потрескавшихся отложений. В присутствии меди осадки грубые. Примеси цинка вызывают темные и даже черные полосы. В присутствии даже небольшого количества свинца образуется темный чешуйчатый налет, который легко отслаивается. Среди анионов наиболее вредным является NO3-, который способствует отслаиванию покрытий. Эти электролиты непригодны для использования. Аналогичное действие оказывают хромовые кислоты.
Органические соединения вызывают точечную коррозию, хрупкость и шероховатость покрытий. Если электролит загрязнен органическими веществами, невозможно получить блестящие осадки.
5.3 Влияние температуры и перемешивания электролита никелирования на качество покрытий.
С повышением температуры выход никеля по току увеличивается, так как из-за ускорения процесса диффузии поляризация уменьшается — потенциал осаждения никеля становится более положительным. При этом выброс водорода меняется незначительно. Тот же эффект дает перемешивание раствора.
5.4 Влияние рН электролита на качество покрытий.
Ионы никеля в электролите окружены оболочкой из дипольных молекул воды. В двойном электрическом слое происходит отрыв некоторых молекул воды. Обезвоживание последних молекул воды требует затрат энергии, что проявляется в увеличении перенапряжения, называемого химической поляризацией. В этом случае равновесный потенциал никеля становится отрицательным даже при малых плотностях тока.
При низких значениях pH <1-2 никель почти не осаждается, а на катоде выделяется только водород. По мере увеличения pH потенциал образования водорода становится более отрицательным, и на катоде создаются условия для совместного выделения водорода и никеля. В этом случае, чем выше pH, тем меньше доля выделения водорода. При высоких значениях pH никель не может осаждаться, так как начинается гидролиз. Продукты гидролиза (оксид и гидроксид никеля), проникая в покрытие, способствуют удержанию пузырьков водорода на поверхности катода; поэтому осажденный никель становится пористым, шероховатым и темным. При очень высоких значениях pH на деталях невооруженным глазом виден зеленый осадок нерастворимых солей никеля.
Твердые и плотные осадки образуются при pH> 5,5, особенно при температурах ниже 20 ° C. Повышение температуры приводит к некоторому снижению внутренних напряжений. Осадки, полученные при низких значениях pH, более мягкие и эластичные.
5.5 Влияние плотности тока и его формы на качество покрытий.
Увеличение плотности тока в заданных пределах способствует снижению внутренних напряжений и увеличению блеска покрытий. Чем выше температура, тем шире рабочий диапазон плотностей тока. Следует помнить, что при значительном завышении плотности тока покрытие меняется с мелкокристаллического (компактного) на дендритное (пыль) из-за нарушения устойчивости плоского фронта роста осадка.
Сегодня перспективно использование нестационарных методов электролиза и ультразвука. Никелирование обратным током и ультразвуковое воздействие проводят в сульфатных электролитах. Никель может быть пассивирован во время анодной поляризации, поэтому осаждение производится короткими анодными импульсами или прерывистым током. Это приводит к активации никеля в процессе нанесения покрытия. Путем реверсирования и прерывания тока получаются покрытия с низкой пористостью, низкими внутренними напряжениями и высокими защитными свойствами.
Последующее применение асимметричного тока и постоянного тока дает положительный эффект. Осаждение постоянного тока улучшает блеск и твердость никелирования.
Гальваника никеля импульсным током позволяет получать зеркальные глянцевые покрытия из обычных электролитов никелирования без использования полирующих добавок.
Наложение ультразвука, а также совместное использование ультразвука и обратного тока позволяет значительно интенсифицировать процесс электроосаждения. При этом увеличивается допустимая плотность тока осаждения, из электролитов обычного состава получаются легкие, прочные и практически беспористые отложения с очень малой толщиной покрытия, при этом улучшается блеск покрытий и снижаются внутренние напряжения.
Для использования нестационарных режимов электролиза нужно использовать выпрямители со специальными функциями.
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозионных повреждений влияют две группы факторов: внешние и внутренние.
Текущее состояние поверхности металла
Когда металлическая поверхность неровная, процесс коррозии идет намного интенсивнее. Если на поверхности есть небольшие выступы, в них начинает скапливаться вода.
Это может отрицательно сказаться на скорости распространения.
Чтобы избежать этого фактора, важно использовать матовый или полированный металл.
Когда сталь гладкая, вода не сильно повреждает ее, потому что постепенно образует однородную пленку по всей поверхности.
Кроме того, использование пассивации, как и ряда других методов, становится хорошим способом уменьшить ущерб.
Степень термодинамической стойкости металла
Разные типы материалов отличаются разными показателями термодинамической устойчивости.
Самые стойкие материалы не портятся в агрессивной среде.
Чтобы понять, имеет ли металл склонность к коррозии под действием термодинамических факторов, измерьте потенциал анодного и катодного процесса, а также изобарно-изотермического.
именно этот фактор имеет большое влияние на возможное влияние окружающей среды на постепенное развитие коррозии.
К сожалению, большинство продаваемых марок металла имеют невысокую долговечность. Существуют также нестабильные разновидности, в которых этот риск нивелируется из-за склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке устроены по-разному. Наилучшими защищенными видами являются те, у которых атомы упакованы неплотно.
Характеристики решетки также учитываются при планировании защиты материала путем создания на нем специальных пленок. И пленка, и сам основной материал должны четко совпадать в композиции или быть максимально близкими.
В этом случае исключено появление напряжений, негативно влияющих на текущее состояние заготовки. При контакте с агрессивной средой материал начинает слой за слоем разрушаться.
Гетерогенность
Считается, что этот фактор напрямую связан с размером зерна металла.
Если в сплаве есть ярко выраженные анодные включения, они сильно влияют на ускорение коррозии.
Катодные включения не так опасны, потому что не влияют на интенсивность процесса. Размер частиц как фактор риска не рассматривается так часто, и на этот показатель можно не обращать внимания.
Основные внешние факторы электрохимической коррозии
Помимо внутренних факторов на металл влияют и внешние факторы.
Они могут не только ускорить, но и замедлить процесс, а также повлиять на характер его протекания.
К ним относятся следующие:
- Температура. Температура сильно влияет на поведение металла в разных условиях. Он во многом определяет, насколько быстро будут растворяться продукты вторичной коррозии. Другие особенности включают запуск и стимуляцию диффузионных процессов в металле, создание перенапряжений на электродах и другие проявления. Когда металлический продукт помещается в растворы с кислородной деполяризацией, при нагревании электролита ускоряется диффузия окислителя. На этом фоне наблюдается резкое снижение перенапряжения ионизации кислорода.
Если деталь находится в неокисляющих растворах кислоты, наблюдается водородная деполяризационная коррозия.
Повышение температуры снижает скорость распространения повреждений, поскольку выброс водорода значительно уменьшается.
Отдельно стоит отметить ситуацию, когда металл уже покрыт специальной защитной пленкой. В этом случае сам тип пленки будет влиять на ее поведение при контакте с различными типами внешних угроз, включая повышение температуры.
Нагрев и охлаждение могут повлиять на состояние катодов и анодов через свои внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы отметили выше, проблемы могут возникнуть из-за того, что разные части детали нагреваются до разной температуры.
В этом случае количество термогальванических пар быстро увеличивается, что стимулирует распространение коррозии на новые участки.
- Уровень pH раствора, в который помещен металл. Такой индикатор, как pH, показывает, насколько активными будут ионы водорода в растворе и как быстро коррозия будет распространяться по материалу. Это опасно, поскольку может непредсказуемо изменить потенциал катодных процессов и образования оксидных пленок. На электродах также создается значительное перенапряжение реакции. Рекомендуется не допускать контакта металла с жидкостями с высоким значением pH.
Если по какой-то причине кусок металла был помещен в раствор, скорость, с которой он движется, а также само наличие внутренних колебаний будут иметь большое значение.
Заранее определить точный эффект будет сложно, потому что всегда сложно предсказать, как будут вести себя нейтральные электролиты.
Считается, что при перемешивании электролита параметры диффузии кислорода изменяются, что существенно влияет на процесс коррозии.
Вы можете меньше обращать внимание на скорость движения электролита, если имеете дело со средами с повышенной кислотностью.
Такое поражение оказывает на них минимальное влияние.
3. Катодные процессы при электроосаждении.
Электроосаждение металлов группы железа из растворов простых солей имеет ряд характеристик по сравнению с другими металлами. Разряд ионов металла происходит при высокой катодной поляризации и низком перенапряжении водорода, что создает некоторые трудности, так как водород выделяется на катоде одновременно с металлом:
Ni2 + + 2e- → Ni0
2Н + + 2е- → Н2
Ферстер внес большой вклад в изучение кинетики электроосаждения никеля. Он и его сотрудники обнаружили, что поляризационные кривые осаждения металлов подгруппы железа имеют логарифмический характер. В этом случае наблюдается значительное катодное смещение даже при малых плотностях тока.
Первоначально считалось, что потенциалы осаждения никеля зависят от pH среды: при уменьшении pH с 5 до 2 потенциалы должны становиться все более отрицательными.
Гластон опроверг эти предположения. Он обнаружил, что в буферном растворе сульфата никеля поляризационные кривые всегда медленно повышаются до -0,57 В, а затем резко возрастают. Экспериментально при 15 ° C из 1 н. Раствора сульфата никеля металл начинает осаждаться на медном катоде точно при -0,57 В. При других температурах потенциал выделения никеля смещается в более отрицательную область. Согласно Glaston, pH не влияет на возможное высвобождение никеля. При уменьшении pH от 5 наблюдается только смещение резкого роста поляризационной кривой (начало осаждения металла) в сторону более высоких значений плотности тока. Этот факт оказался аналогичным для железа и кобальта.
Таким образом, Гластон пришел к выводу, что во время осаждения никеля процесс не контролируется замедленным разрядом. По его мнению, значительная катодная поляризация наблюдается только перед началом осаждения металла; после этого поляризация немного превышает поляризацию, возникающую при осаждении свинца или меди.
Повышение температуры, естественно, уменьшает поляризацию.
Видно, что в растворах потенциал катода после достижения значения -0,57 В изменяется незначительно с увеличением плотности тока. В то же время в отсутствие ионов никеля в растворе обрыва поляризационной кривой не наблюдается. При замене сульфатов ацетатами, хлоридами или нитратами потенциал разрыва поляризационной кривой остается неизменным (-0,57 В при 15 ° C). Изменение концентрации никеля в растворе на 0,01 N привело к сдвигу потенциала на -0,06 В. Изменение температуры при 55 ° C сместило потенциал перегиба до -0,43 В и снова повысило. Более высокая температура (до 95 ° C) сместила потенциал перегиба в еще более положительную область (до -0,29 В). Следовательно, согласно Гластону, при температурах 15 °, 55 °, 95 ° C поляризация катодной поляризации в начальный момент эволюции никеля составляет соответственно 0,33, 0,19 и 0,06 В, а значение pH не изменяется влияют на потенциал осаждения металла. Однако с уменьшением pH плотность тока, при которой достигается этот потенциал, значительно уменьшается (что противоречит теории Кольшютера).
Гластон, помимо изучения поляризации при осаждении никеля, первым заметил, что электролитический никель осаждается в очень несбалансированной форме, отличной от металлургической.
Ферстер обратил внимание на то, что Гластной допустил существенную ошибку: значения потенциалов для данной плотности тока были зафиксированы на основе кратковременных наблюдений, во время которых эти потенциалы не были достаточно стабилизированы. Кроме того, недостаточно внимания уделяется защите катодного пространства от доступа кислорода. Устраняя эти недостатки, Ферстер смог получить никель при 16 ° C из 1 н. Раствора хлорида никеля при потенциале -0,42 В. В растворах серной кислоты никель начал осаждаться при потенциале -0,50 В, т. Е. На 0,07 В меньше отрицательного значения, чем указано Glaston. Природа аниона, по мнению Ферстера, повлияла на потенциал выделения никеля — в растворах серной кислоты он оказался более отрицательным.
Катодная поляризация оказывает заметное влияние на структуру электролитического осадка и на равномерность распределения металла на поверхности катода. С этой точки зрения катодная поляризация должна быть максимально увеличена. В некоторых случаях процесс вообще не происходит без значительной катодной поляризации.
Основные объекты коррозии
Неоднородные участки металла обнаруживаются на поверхности изделия случайным образом и зависят от технологии и качества их изготовления, поэтому коррозионные повреждения часто носят локальный характер. Кроме того, место коррозии зависит от неоднородности:
- защитные оксидные пленки;
- электролит;
- влияние внешних факторов (нагрев, радиация);
- внутренние напряжения, вызывающие неравномерные деформации.
Сварные и заклепочные соединения являются яркими представителями контакта посторонних металлов, подверженных активной электрохимической коррозии. Сварка и клепка — самые распространенные технологии изготовления неразъемных соединений во всех основных отраслях промышленности и крупных трубопроводных системах:
- механическая промышленность;
- судостроение;
- нефтепроводы;
- газопроводы;
- водопроводные трубы.
Наиболее значительное разрушение сварных и клепаных соединений происходит в морской воде, наличие соли в которой значительно ускоряет процесс коррозии.
Катастрофическая ситуация произошла в 1967 году с транспортером минералов «Анатина», когда морская вода из высоких штормовых волн попала в трюмы корабля. Медные конструкции во внутренней облицовке трюмов и стального корпуса способствовали созданию коррозионного элемента в электролите с морской водой. Переходная электрохимическая коррозия вызвала размягчение корпуса корабля и возникновение аварийной ситуации до тех пор, пока экипаж не был эвакуирован.
Благоприятные эффекты гальванической коррозии очень редки. Например, при установке новых труб в системах горячего отопления жилых домов. Резьбовые соединения соединений начинают протекать при первоначальном пуске до тех пор, пока продукты коррозии, состоящие из гидрата железа, не заполнят микропоры резьбы.
Независимо от типа коррозии, химической или электрохимической, ее последствия одинаковы: разрушение продуктов, стоимость которых огромна. Кроме того, помимо прямых потерь от материалов, пришедших в негодность, бывают косвенные убытки, связанные с потерями продукции, простоями при замене непригодных материалов и деталей, нарушением регламентов технологического процесса.
Отличия химической коррозии от электрохимической
Под процессом электрохимической коррозии понимается окислительно-восстановительная реакция коррозионной среды из-за электронов металла, которые уносятся от него под действием электрического потенциала, возникающего в электролите, который является этой окислительной средой. Ионизация сопровождается разрушением той части, которая находится в непосредственном контакте со средой, а ржавчина, видимая невооруженным глазом, представляет собой не что иное, как уменьшенную коррозионную среду.
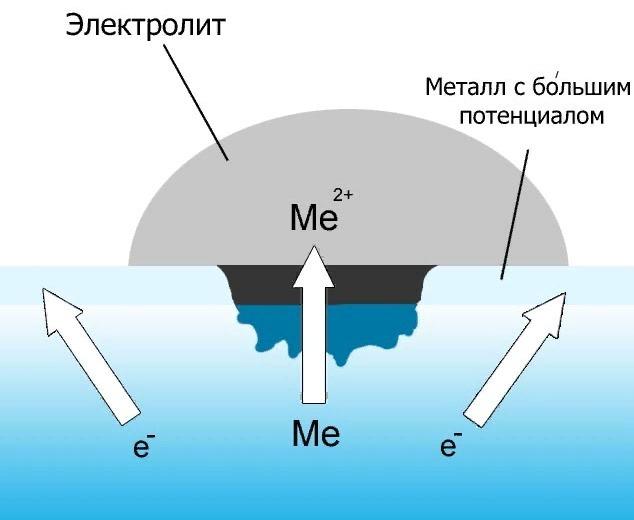
Если говорить о том, чем химическая коррозия отличается от электрохимии, то можно выделить несколько принципиальных моментов:
- Суть электрохимической коррозии — это процесс, происходящий в электролите, и это главное.
- В электрохимическом токе обязательно присутствует электрический ток, чего нельзя сказать о химическом окислении.
- Электрохимическая коррозия не характеризуется одностадийным переходом частиц от металла к окисляющему компоненту, а определяется величиной потенциала. То есть, чем больше потенциал, тем больше скорость частиц и тем быстрее процесс восстановления агрессивной среды. В химическом процессе разрушение вещества сопровождается одновременным восстановлением агрессивной среды.
Выделяют следующие виды электрохимической коррозии:
- Межкристаллитный. Электрохимическое явление, когда в алюминии, никеле и других элементах наблюдается разрушение зерна по его краю, и происходит это избирательно. В результате конструкция теряет прочность и ухудшаются пластические свойства. Опасность заключается в том, что этот электрохимический процесс может быть визуально невидимым.
- Питтинг. Проявляется поражением точечных участков на таких элементах, как медь, ее сплавы и другие. Размер отдельных участков, на которых возникает коррозия, обычно не превышает 1,5 миллиметра. Электрохимическая ямка бывает поверхностной, а также открытой и закрытой.
- Слот. Опасный вид электрохимической коррозии, сопровождающийся быстрым и усиленным разрушением участков с микротрещинами, трещинами или трещинами. Коррозия может возникнуть в любой среде.
Современные методы борьбы
Многочисленные исследования и разработки технического прогресса привели к созданию целой системы методов и средств борьбы с коррозией. Можно выделить три основных направления защиты от коррозии:
- Конструктивные решения.
- Активные методы.
- Пассивные методы.
Конструктивные решения заключаются в выборе материалов, которые минимально подвержены коррозии с точки зрения физических свойств:
- нержавеющие стали;
- легированные стали;
- цветные металлы.
Активные методы борьбы подсказала сама электрохимическая коррозия. К защищаемой металлической конструкции прикладывается постоянное напряжение таким образом, чтобы увеличить ее электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — это жертвенный анод, имеющий низкий электродный потенциал, из-за чего он разрушается вместо защищаемого объекта.
Пассивные методы заключаются в нанесении защитных покрытий. Технологический прогресс в этой области стал развиваться с применением простейших лакокрасочных материалов, предотвращающих попадание кислорода, влаги и конденсата на поверхность металлов. Итак, появились электролитические покрытия на основе:
- цинк — цинкование;
- хром — хромирование;
- никель — никелирование.
Оцинкованное железо, никелированные и хромированные столовые приборы, пищевые консервы служат долгие годы, не подвергаясь электрохимической коррозии, сохраняя хороший внешний вид и предотвращая порчу продуктов.
2. Электролиты для нанесения.
Для никелирования используются сульфатный, хлоридный, сульфаминовый, фторид бора, щавелевая кислота и другие электролиты, в которых никель находится в форме двухвалентного катиона. Разработано большое количество составов и режимов осаждения, позволяющих получать никелевые покрытия с различными физико-химическими свойствами.
Очень часто используют сульфатный электролит Watts, поскольку содержащиеся в нем вещества наиболее доступны, их легко приготовить и поддерживать.
Основным компонентом сульфатного электролита является сульфат никеля NiSO4 • 7H2O. Сульфат никеля СН-1 технический сорт состоит из кристаллов зеленого цвета. Растворимость без нагрева достигает 300 г / л.
Помимо солей никеля, которые являются источниками катионов никеля, электролит содержит компоненты, предназначенные для увеличения электропроводности, стабилизации кислотности (буферные добавки), улучшения растворимости анодов (хлоридов), придания блеска осадкам и предотвращения различных дефектов, возникающих при никелировании покрытие.
Если концентрация NiSO4 • 7H2O не превышает 300 г / л, в электролит иногда добавляют Na2SO4 • 10H2O и MgSO4 • 7H2O для увеличения электропроводности. Сульфат натрия имеет значительно более высокую электропроводность, но магний входит в состав никелевых покрытий, что делает их мягче и светлее.
Борная кислота — наиболее широко используемое буферное соединение. Борная кислота регулирует pH не только в общем объеме электролита, но и в слое возле катода, где уровень pH постоянно увеличивается из-за разряда и выделения водорода. При pH> 4 осаждение происходит через образовавшуюся пленку гидроксида никеля. Для электролитов с низким pH более эффективны добавки фтора.
