Общие сведения
Сложные эфиры (от греческого слова эфир — эфир, небо, воздух) (эфиры) — производные спиртов, енолов и фенолов (общая формула ROR ‘). Если радикалы одинаковые, простые эфиры симметричны, если разные — асимметричны или смешаны. В зависимости от природы радикалов различают диалкил, диарилов, дициклоалкил, арилалкил, алкилвинил и т.д. Простые эфиры также включают глим, карбитолы, целлозол и некоторые гетероциклические соединения (1,4-диоксан, оксиран, оксолан, тетрагидрофуран и т.д.).
Названия эфиров образованы от названий углеводородных радикалов путем добавления суффикса -ny и слова «эфир», например, CH3-O-CH3 — диметиловый эфир, CH3-O-C2H5 — метилэтиловый эфир.
Сложные эфиры считаются алкокси, циклоалкокси, арилокси производными углеводородов; в этом случае радикал считается более сложным как исходная структура: CH3-O-CH 2 CH 3 — метоксиэтан, C2H5O-C3H7 — этоксипропан, C6H5-OCH3 — метоксибензол.
Некоторые эфиры имеют банальные названия: С6Н5-ОСН3 — анизол, С6Н5-С2Н5 — фенетол, 2-СН3ОС6Н4ОН — гваякол. Диметиловый и метилэтиловый эфиры при нормальных условиях являются газами. Все остальные эфиры представляют собой бесцветные жидкости или кристаллические вещества с приятным или характерным «эфирным» запахом, плохо растворяются в воде, хорошо — в органических растворителях (таблица).
Получение простых эфиров.
Наиболее удобным методом является взаимодействие алкоголятов щелочных металлов R’ONa с алкилгалогенидами RHal, этот метод может быть использован для получения как симметричных (рис. 4A), так и асимметричных (рис. 4B) эфиров. В промышленности симметричные эфиры получают путем обезвоживания (удаления воды) спиртов с помощью серной кислоты (рис. 4В); этот метод позволяет получать простые эфиры, содержащие не более 5 атомов углерода в органической группе R.
Анализ простых эфиров
Химическое поведение алифатических и ароматических простых эфиров согласуется с поведением родственных углеводородов. Эфиры отличаются от углеводородов растворимостью в холодном концентрированном сульфате кислоты из-за способности простых эфиров образовывать соли оксония.
Если эфир уже был описан, то его можно идентифицировать по физическим свойствам или химически, путем расщепления путем нагревания с концентрированным йодистым водородом и последующего распознавания продуктов реакции.
Ароматические сложные эфиры могут быть превращены в твердые продукты нитрования или бромирования и их точки плавления по отношению к производным, описанным выше.
Расщепление эфира иодистым водородом используется для определения количества алкоксигрупп в алкилариловом эфире по методу Цейзеля.
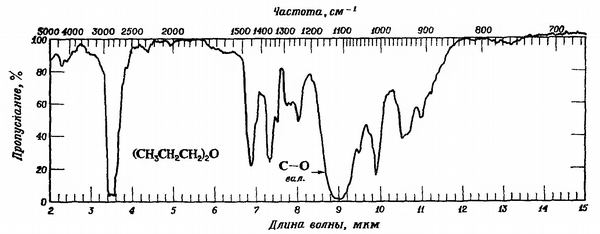
Спектральный анализ проводится для распознавания эфира. В инфракрасном спектре простого эфира нет полосы $ OH $, характерной для спиртов, но есть сильная полоса $ CO $ в области 1060-1300 см $ ^ {- 1} $: для алкиловых эфиров 1060-1150 см $ ^ {- 1} $, для ариловых и виниловых эфиров 1200–1275 см $ ^ {- 1}$:
Рисунок 7.
Применение некоторых простых эфиров
Использование эфиров основано на их способности хорошо растворять органические вещества (смолы, жиры и т.д.).
Диэтиловый эфир (техническое название «серный эфир») используется:
- как реакционная среда для органических синтезов;
- для извлечения определенных веществ (например, спиртов из водных растворов);
- как растворитель синтетических и природных смол, солей целлюлозы при производстве пороха;
- как топливный компонент в авиации;
- в медицине при ингаляции и под местной анестезией.
Диизопропиловый эфир:
- это отличный растворитель для животных жиров, минеральных и растительных масел, синтетических и природных смол;
- используется как добавка к моторному топливу, повышая тем самым октановое число;
- используется для отделения урана от продуктов его деления;
- для извлечения уксусной кислоты из водных растворов.
Анизол и фенетол используются в качестве промежуточных продуктов при приготовлении лекарств, красителей и ароматизаторов. Из фенетола мы получаем фенетидин и его производные, используемые в медицине как жаропонижающие вещества.
Дифениловый эфир (дифенилоксид) используется в качестве теплоносителя, например, смеси доутерм.
Циклический эфир диоксана:
- хороший растворитель для ацетата целлюлозы, растительных и минеральных жиров и масел, восков, красок;
- используется в качестве реакционной среды для органических синтезов;
- используется для стабилизации 1,1,1-трихлорэтана для его транспортировки в алюминиевых контейнерах и хранения.
Абсолютный эфир
Абсолютный эфир — это эфир, не содержащий влаги и спирта (например, диэтиловый эфир $ C_2H_5-O-C_2H_5 $, используемый в реакции Гриньяра). Абсолютный эфир можно получить путем перегонки простого эфира над концентрированным сульфатом кислоты, который удаляет спирт, воду и перекись. Впоследствии абсолютный эфир хранится на металлическом натрии.
Физические, химические и фармакологические свойства
Таблица. Свойства эфиров
| Формула | Имя | Ткип, оС | Tm, oC |
| CH3OSN3 | Диметиловый эфир (метоксиметан) | -23,7 | -138,5 |
| CH3OS2H5 | Метилэтиловый эфир (метоксиэтан) | 8 | — |
| 2Н5ОС2Н5 | Диэтиловый эфир (этоксиэтан) | 34,6 | -116,3 |
| C2H5OCH = CH2 | метилвиниловый эфир (этоксиэтилен) | 36 | — |
| 3Н7ОС3Н7 | Дипропиловый эфир (пропоксипропан) | 91 | -122 |
| 6Н5ОСН3 | Метоксибензол (анизол) | 155 | -37 |
| 6Н5ОС2Н5 | Этоксибензол (фенетол) | 172 | -33 |
| 6Н5ОС6Н5 | Дифениловый эфир (феноксибензол) | 259 | 27,5 |
Сложные эфиры — довольно инертные вещества. Разбавленные минеральные кислоты, водные растворы щелочей и щелочных металлов с ними не взаимодействуют. Реакционная способность простых виниловых и ариловых эфиров обусловлена углеводородными радикалами. Через неразделенные пары электронов на атоме кислорода простые эфиры проявляют слабые основные свойства и образуют нестабильные оксониевые соли с концентрированными минеральными кислотами.
RR’-OH + Cl-,
и с кислотами Льюиса, эфиратами (RR’OBF3). Диалкиловые и алкилариловые эфиры под действием НЕ разлагаются на галогеналканы и соответствующий спирт или фенол:
CH3OCH3 + NO → CH3OH + CH3I.
Диариловые эфиры устойчивы к концентрированному йодистому водороду. Расщепление метилового и этилалкилового эфиров используется для количественного определения метокси- и этоксигрупп (метод Цейзеля). Концентрированная H2SO4 превращает сложные эфиры сложных веществ серной кислоты, а виниловые эфиры в кислой среде гидролизуются в альдегиды или кетоны и спирты:
Виниловые эфиры способны к полимеризации, что используется при синтезе ВМС. Под действием алкил натрия или алкиллития на простые эфиры отщепление происходит с образованием алкенов:
CH3CH2OCH2CH3 + RNa 1 стрелка. Eps CH2 = CH2 + C2H5ONa + RH.
Арилалкиловые эфиры под действием H2SO4, AlCl3 изомеризуются в орто- и пара-алкилзамещенные фенолы, а алилфениловые эфиры — в орто- и пара-алилфенолы. При длительном покое простые эфиры окисляются кислородом воздуха с образованием взрывоопасных гидропероксидов RO-OH и пероксидов ROOR. Поэтому перед использованием эфиров необходимо провести тест с раствором KI. Наличие перекисей подтверждает коричневатый цвет раствора. Для разрушения пероксидов эфира их обрабатывают NaOH или восстановителями Na2SO3, FeSO4 и т.д. Для получения симметричных сложных эфиров используют реакцию межмолекулярной дегидратации спиртов в присутствии концентрированной H2SO4 или других веществ, поглощающих воду. Важным методом синтеза симметричных и асимметричных эфиров является реакция алкоголятов и фенатов с алкилгалогенидами (реакция Вильямсона). Для синтеза арилалкиловых эфиров вместо арилгалогенидов можно использовать диалкилсульфаты:
C6H5ONa + (CH3) SO4 C6H5OCH3 + CH3OSO3Na.
простые эфиры также образуются путем добавления к олефинам спиртов или фенолов. Простые алкилвиниловые эфиры получают нагреванием спиртов с ацетиленом
HC = -CH + HOCH2CH3 1 стрелка. Eps CH2 = CH-O-C2H5.
Реакция ацетилена с диазометаном приводит к образованию алкиловых и арилметиловых эфиров.