- Что такое галогены
- Перечень и общая характеристика галогенов
- Способы получения
- Получение хлора
- Получение фтора
- Получение брома
- Получение йода
- Применение галогенов
- Физические свойства
- Химические свойства галогенов
- С неметаллами
- С металлами
- Реакции замещения
- С водой
- С растворами щелочей
- Получение
- Фтор
- Хлор
- Бром и йод
- Закономерности галогенов
Что такое галогены
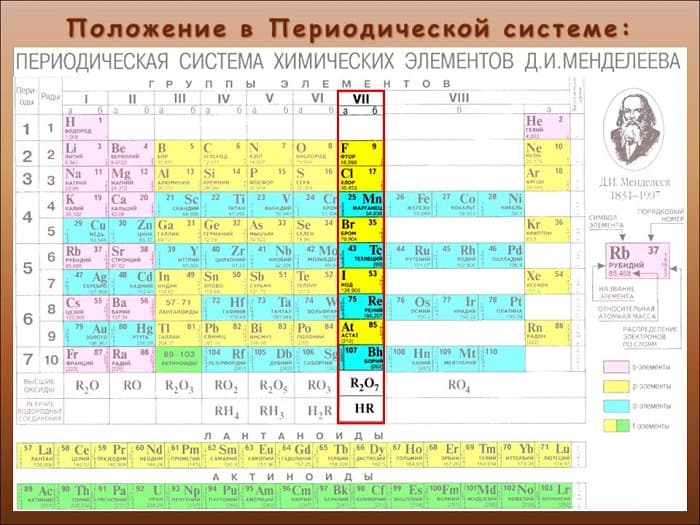
Определены как элементы 17-й группы периодической таблицы Менделеева. Сторонники «старой школы» сказали бы: «основная подгруппа VII группы».
Название представляет собой сборник греческих слов. Это примерно означает носитель соли. Это определение было дано в 19 веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов

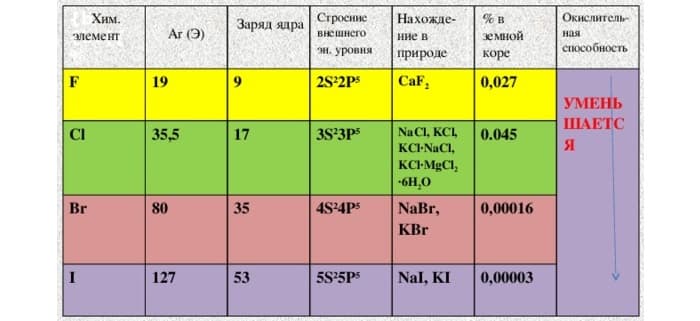
Первые четыре пункта в списке знакомы. Следует отметить, что хотя вещества достаточно распространены, в природе они не встречаются в чистом виде. Только в составе соединений.
Астатин — не только редкий элемент, но и самый редкий из всех, встречающихся на планете. Его «запасы» оцениваются через год, достоверность свойств неизвестна. Потому что из-за радиоактивности и низкой «продолжительности жизни» невозможно было изолировать в достаточном количестве.
Теннесси существует вполне теоретически. На Земле по крайней мере не встречается. Количество записей, зарегистрированных (и признанных) в лаборатории, составляет 6 ядер. Включая изотоп.
Но общий принцип построения внешнего энергетического уровня хорошо известен: ns2np5. «N» означает период положения элемента.
легко видеть, что до «идеального» инертного только чего-то не хватает электронике. Так и хочется. Неудивительно, что они такие агрессивные.
Способы получения
Получение хлора
В промышленности хлор получают электролизом.
- Электролиз расплава хлорида натрия
- 2 NaCl → 2Na + Cl2
- (-): Na + + 1 e → Na0
- (+): 2 Cl- — 1 e → Cl20
- Электролиз раствора хлорида натрия
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
- (-): 2H2O + 2 e → H20 + 2OH-
- (+): 2Cl- — 1 е → Cl20
В лаборатории хлор образуется в результате реакции соляной кислоты и сильных окислителей.
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
Получение фтора
Фтор получают электролизом расплава.
2КХФ2 → 2К + Н2 + 2Ф2
Получение брома
Бром получают путем окисления.
2HBr + Cl2 → Br2 + 2HCl
Получение йода
Йод образуется в результате окисления.
2КИ + Cl2 → I2 + 2KCl
Применение галогенов
Костная ткань и зубная эмаль содержат соединения фтора. При недостатке фтора разрушается зубная эмаль. Плазма крови содержит различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фтористый кислород используется в производстве ракетного топлива. Соединения фтора содержатся в зубных пастах. С помощью молекулярного хлора вода дезинфицируется, а также используется для отбеливания тканей, бумаги, дерева. Поваренная соль — это хлорид натрия, который добавляют в пищу. А поташ используется как удобрение.
Физические свойства

Галогены — очень ярко выраженные неметаллы. Летучий, с характерным резким «ароматом». Кроме того, для йода (I2) жидкое агрегатное состояние обычно не является типичным. При нагревании он просто превращается в пурпурный дым.
Хлор — это настоящее боевое химическое средство. И это использовалось как таковое. При попадании в глаза и незащищенные органы образует кислоты. Со своими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг / л.
Цветовая насыщенность увеличивается с более «тяжелыми» ядрами. С другой стороны, активность снижается.
Растворимость в воде ограничена. Он лучше работает с органическими растворителями. Растворы имеют оригинальный цвет: от слегка желтого до фиолетового.
Химические свойства галогенов
Галогены (Hal) — сильные окислители, а фтор настолько агрессивен, что вступает в реакцию со своими аналогами. Это происходит во время разминки. Степень окисления «пострадавших» +1.
Общее уравнение:
![]()
Можно сказать, что F реагирует со всеми простыми веществами, за исключением некоторых благородных газов. И так (с радиацией):
![]()
Остальные элементы ряда не взаимодействуют с:
ИЛИ;
- <p>N;
- С (в алмазной модификации);
- Pt, Au;
- Xe, Kr.
С неметаллами
Водород окисляет фтор в любых условиях взрывоопасно. Cl с УФ-подсветкой или с подогревом. Но тоже шумно. Остальное просто греется. Но уравнение то же:
![]()
Они совершенно по-разному взаимодействуют с фосфором:
* F для получения пентафторида. Единственный, без подогрева:
![]()
* Хлор и бром в зависимости от концентрации:
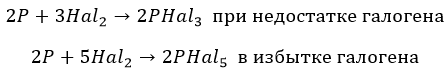
йод не является сильным окислителем:
![]()
∗ даже с серым не все очевидно. Но не с фтором. Окисление максимальное, но при нагревании:
![]()
* Бром и хлор реагируют атипично и «неохотно»:
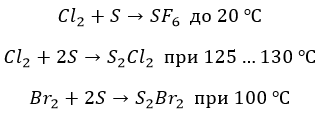
С металлами
Ничто не может противостоять фториду. Даже знатный класс хоть и засветился:
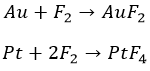
Остальные металлы способны к другим галогенам. Не обошлось и без подогрева:
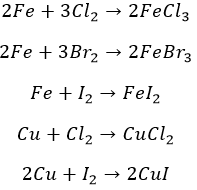
Реакции замещения
Устраните агрессивных «тяжелых» соседей по группе:
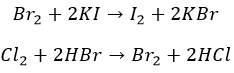
И они не проводят церемоний с неметаллами:
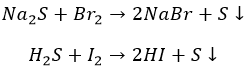
Хлор, будучи более активным, ведет себя несколько иначе:
![]()
С водой
Фтор в его репертуаре. Вода будет светиться синим пламенем и напрягаться, чтобы выплюнуть плавиковую кислоту:
![]()
Хлор с бромом намного тише. А процессы нестабильные, обратимые:
![]()
Йод не вступает в видимое взаимодействие с водой.
С растворами щелочей
И в этом случае фтор проявляет себя как сильный окислитель:
![]()
Остальные ведут себя как вода. Но процесс при разных температурах идет по разным сценариям:
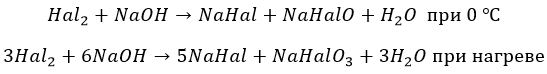
Йод реагирует только по второму варианту.
Получение
Выделить такое активное вещество не так просто, чтобы оно изо всех сил реагировало со всем вокруг.
Фтор
Обычно получают из комплексных солей. При интенсивном нагревании (термолизе) разложение на газ происходит проще и желательнее.

Или электролизом КФ * 3ХФ. Аналогичный метод используется в промышленности.
Хлор
Из соляной кислоты. Неприятно и опасно даже в лаборатории:
![]()
Промышленно добывается из поваренной поваренной соли электролизом:
![]()
Бром и йод
«На коленке» — из солей. Окислители в кислой среде:
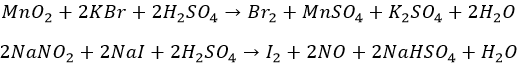
Химическим предприятиям не нужно покупать сырье. Морская вода, скважинные жидкости. Остатки сгоревшего океана / водорослей — настоящий минерал йода.
Закономерности галогенов
Для получения свободных галогенов необходимо оценить способность ионов к окислению. В серии F-Cl-Br-I атомный радиус увеличивается. Это означает, что иону труднее удерживать электроны и, следовательно, окислительные свойства в ряду снижаются.
В серии F-Cl-Br-I электроотрицательность уменьшается. Следовательно, фтор является наиболее активным элементом. У него наименьший атомный радиус, поэтому он активно притягивает к себе электроны.
