Решение а
$ S_ {2} $ — неполярная ковалентная связь, поскольку состоит из атомов одного и того же элемента.
Сера (S) — элемент основной подгруппы VI группы, неметалл. Его атомы имеют шесть электронов на внешнем слое.
Для определения количества неспаренных электронов воспользуемся формулой:
8 — N = количество неспаренных электронов, где N — номер группы химического элемента.
Следовательно, атомы серы будут иметь (8 — 6 = 2) два неспаренных электрона.
В молекуле $ S_ {2} $ атомы связаны двумя парами общих электронов, поэтому связь двойная.
Схема образования химической связи в молекуле $ S_ {2}$:

S = S
$ K_ {2} O $ — ионная связь, так как образована атомами металлических и неметаллических элементов.
Калий — элемент основной подгруппы I группы Д. И. Менделеева, металл. Его атому легче отдать внешний электрон, чем принять недостающие семь.
Кислород — это элемент основной подгруппы VI группы, неметалл. Его атому легче принять 2 электрона, чем отдать 6 электронов с внешнего уровня.
Находим наименьшее общее кратное среди зарядов образовавшихся ионов, оно равно 2 (2 * 1). Затем мы определяем, сколько атомов калия нужно взять, чтобы образовались два электрона (т. Е. Нужно взять 2 атома калия), и сколько атомов кислорода нужно взять, чтобы они могли взять два электрона (т. Е. Вам нужно взять 2 атома калия) взять 1 атом кислорода).
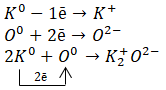
$ H_ {2} S $ — ковалентная полярная связь, так как образована атомами разных элементов — неметаллов.
Водород (H) — элемент основной подгруппы группы VII, неметалл. Его атомы имеют семь электронов на внешнем уровне.
Непарные электроны будут: 8-7 = 1.
Сера (S) — элемент основной подгруппы VI группы, неметалл. Его атомы имеют шесть электронов на внешнем слое.
Непарные электроны будут: 8-6 = 2.
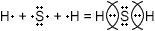
H — S — H
Суммарные электронные пары будут сдвинуты с водорода на серу, как более электрокритический элемент.
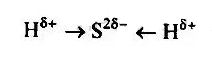
Решение б
$ N_ {2} $ — неполярная ковалентная связь, поскольку состоит из атомов одного и того же элемента.
Азот (N) — элемент основной подгруппы группы V, неметалл. Его атомы имеют пять электронов на внешнем уровне.
Непарные электроны будут: 8-5 = 3.
В молекуле $ N_ {2} $ атомы связаны тремя парами общих электронов, поэтому связь тройная.
Схема образования химической связи в молекуле $ N_ {2}$:

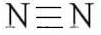
$ LiF $ — ионная связь.
Литий — элемент I группы основной подгруппы — металл. Его атому легче отдать 1 внешний электрон, чем принять 7.
Фтор — элемент основной подгруппы VII группы, неметаллический. Его атому легче принять 1 электрон, чем отдать 7 электронов с внешнего уровня.
Находим наименьшее общее кратное среди зарядов образовавшихся ионов, оно равно 1 (1 * 1). Затем мы определяем, сколько атомов лития нужно взять, чтобы они могли отдать электрон (т. Е. Нужно взять 1 атом лития), и сколько атомов фтора нужно взять, чтобы они могли взять электрон (т. Е нужно взять 1 атом фтора).

$ Cl_ {3} N $ — ковалентная полярная связь.
Хлор (Cl) — элемент основной подгруппы группы VII, неметалл. Его атомы имеют семь электронов на внешнем уровне.
Непарные электроны будут: 8-7 = 1.
Азот (N) — элемент основной подгруппы группы V, неметалл. Его атомы имеют пять электронов на внешнем уровне.
Непарные электроны будут: 8-5 = 3.

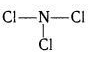
Обычные электронные пары будут смещены с азота на хлор как на более отрицательный в электрическом отношении элемент.
Ионная связь
Образуется между металлом и неметаллом, т.е существует большая разница в ЭО между веществами. Один из элементов отдает свои электроны и становится положительно заряженным. Электроноакцепторный элемент заряжен отрицательно.

Водородная связь
Водородная связь — это связь между электроотрицательным атомом (F, O, N) и атомом водорода, ковалентно связанным с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (точка кипения, точка плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи приводят к связыванию молекул, что приводит к увеличению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при + 78,3 ° С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, только при -24 ° С (молекулярная формула обоих веществ С2Н6О).
| Тип сообщения | Примеры |
| Неполярный ковалентный | Cl2, O2, Br2, I2, N2 и т.д. |
| Ковалентный полярный | HCl, H2S, HBr, H2O, SO2, SO3 и т.д. |
| Ионный | NaCl, KCl, CaBr2, Na2O и др. |
| Металл | Na, Ca, Zn, Al и др. |
| Водород | Среди молекул:
|
Металлическая связь
Металлическая связь: обобществление валентных электронов «электронного газа» осуществляется в простых веществах, металлах и их сплавах (Na, Fe, Cr, Al и т.д.).
Ковалентная связь
Ковалентная неполярная связь
Образованные среди одних и тех же неметаллов, то есть эти элементы имеют одинаковый ЭО.
Рассмотрим образование неполярной ковалентной связи на примере водорода:
![]()
Ковалентная полярная связь
Он образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи на примере сероводорода:
![]()
