- Что такое Э.Д.С и от чего она зависит
- Элемент Вольта
- Готовые работы на аналогичную тему
- Область действия сторонних ЭДС
- Помощь эксперта
- Стандартные электродные потенциалы
- Как устроен и как работает гальванический элемент с водородным электродом
- ЭДС гальванического элемента с водородным электродом
- Э.Д.С гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
- Ряд напряжений металлов. Что это такое и каково его значение
- Закон сохранения энергии для цепи с током с источником ЭДС гальваническим элементом
Что такое Э.Д.С и от чего она зависит
Сила, которая позволяет электронам перемещаться по цепи в гальваническом элементе, называется электродвижущей силой (E), что в данном случае означает равную напряжению и потенциалу. Поэтому EDS измеряется в вольтах.
Напомним, что 1 вольт (В) — это электродвижущая сила, которая позволяет заряду в 1 кулон (Кл) приобретать энергию в 1 джоуль (Дж).
ЭДС гальванического элемента определяется многими факторами:
— осуществляется в элементе с помощью химического процесса;
— концентрация участников процесса (как реагентов, так и продуктов);
— температура.
Если гальванический элемент работает в стандартных условиях, его стандартные номера обозначаются буквой E°.
Элемент Вольта
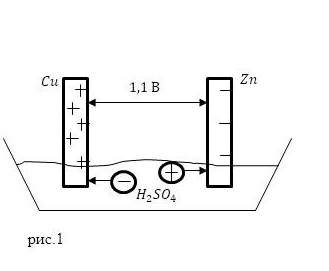
Этот гальванический элемент состоит из медных и цинковых пластин, помещенных в раствор серной кислоты (рис. 1). Электрохимические потенциалы цинка и меди приведены выше, получаем, что ЭДС элемента Вольта равна:
Готовые работы на аналогичную тему
470 ₽ Электродвижущая сила гальванического элемента Курсовая работа 260 ₽ Электродвижущая сила гальванического элемента Резюме
$ = 0,6 — (- 0,5) = 1,1 (В).$
Рисунок 1. Элемент Вольта. Author24 — обмен документами для студентов онлайн
Область действия сторонних ЭДС
Не следует предполагать, что внешняя ЭДС занимает все пространство между пластинами. В элементе Вольта возникают два боковых электромагнитных поля, общие для поверхностных слоев, где пластины контактируют с раствором кислоты. Эти слои примерно равны диаметру молекулы. В остальном объеме раствора сторонних электромагнитных полей нет.
Если соединить пластины элемента проводником, в нем возникнет электрический ток, направленный от медной пластины (положительный электрод) к цинковой пластине (отрицательный электрод).
В растворе в пространстве между электродами ток направлен от цинка к меди. Получается, что линии СС замкнуты.
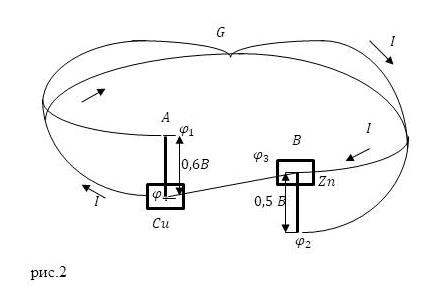
Определите изменение потенциала в цепи с током. В направлении протекания тока потенциал уменьшается на сопротивлении проводника. Рассмотрим рис. 2, который отражает изменение потенциала в замкнутой цепи, в которой в качестве источника ЭДС используется элемент Вольта. Точки $ A $ и $ B $ соответствуют поверхностным контактам медных и цинковых электродов с растворами, в которых действуют внешние электродвижущие силы. Разница между этими силами равна внешней ЭДС элемента. Эта ЭДС равна полному падению потенциала на сопротивлении внешней цепи в секции $ AGB $ и на сопротивлении электролита в секции $ BDA $. Сопротивление электролита называется внутренним сопротивлением ячейки.
Закон Ома для всей цепочки записывается как:
$ Ɛ_ {st} = I (R + r) (1)$,
где это находится:
- $ Ɛ_ {st} $ — внешняя ЭДС элемента;
- $ R $ — сопротивление внешней цепи;
- $ r $ — внутреннее сопротивление элемента.
Внешняя ЭДС элемента определяется свойствами элемента и не связана с силой тока в цепи. Формула (1) показывает, что падение напряжения на внешней цепи ($ U = IR $) не равно ЭДС элемента, а всегда меньше:
$ IR = Ɛ_ {st} -Ir $ (2).
$ U $ — это напряжение на выводах рабочего элемента при текущем токе в цепи. Из выражения (2) следует, что при увеличении силы тока напряжение во внешней цепи уменьшается. Кроме того, это уменьшение тем больше, чем больше внутреннее сопротивление элемента.
При использовании гальванического элемента желательно, чтобы напряжение во внешней цепи в наименьшей степени зависело от нагрузки (от силы тока).
Важной особенностью элемента является его внутреннее сопротивление. Чем меньше внутреннее сопротивление элемента при прочих равных, тем качественнее источник ЭДС.
Помощь эксперта
Стандартные электродные потенциалы
со времен Галилея было известно, что все в мире относительно. С тех пор мы можем рассматривать любое событие, процесс и явление в связи с другими событиями, процессами или явлениями.
Чтобы понять, что такое конкретный металлический ЭЦП, необходимо сравнить его с такой ЭЦП, размер которой нам наверняка известен. Для этого был построен гальванический элемент с газообразным водородом в качестве электрода.
Как устроен и как работает гальванический элемент с водородным электродом
Значение потенциала водородного электрода, с которым будут сравниваться значения измеренных потенциалов электродов гальванического элемента, условно принимается равным нулю.
Конечно, мы не можем подключить к цепи сам водород, так как это газообразное вещество.

Следовательно, схема включает тонкую пластину из платины Pt, которая имеет дополнительное покрытие из платины, нанесенное на ее поверхность путем электролиза. Здесь адсорбируется газообразный водород, который дополнительно задерживается стеклянной колбой. Последний залит электролитом: 2н раствором серной кислоты H2SO4. Кроме того, сюда подается водород Н2 из баллона.
Вторая часть гальванического элемента, как правило, представляет собой цинковую пластину (анод), погруженную в раствор соли того же металла, например сульфата цинка ZnSO4. После замыкания цепи электроны анода переходят в катодное пространство и обеспечивают восстановление там ионов водорода H+:

Рассматриваемый гальванический элемент схематически записывается следующим образом:

После замыкания цепи стрелка прибора покажет значение потенциала 0,76 В.
ЭДС гальванического элемента с водородным электродом
Таким образом, стрелка вольтметра остановилась на 0,76 В. Это значение ЭДС гальванического элемента, устройство которого мы рассмотрели.
Поскольку в гальваническом элементе всегда одновременно происходят два противоположных процесса: окисление и восстановление, то элемент EDS будет представлен суммой двух потенциалов: окисления и восстановления соответственно

Итак, посчитаем:

Поскольку цинк окисляется во время процесса, рассчитанное (и измеренное) значение EDS будет относиться не столько ко всему элементу, сколько к цинковому аноду.
Точно так же, имея в наличии стандартный водородный электрод, были получены значения других потенциалов стандартного электрода.
Э.Д.С гальванического элемента определяется по формуле, учитывающей электродные потенциалы участников процесса
Возможны случаи, когда электрод в одном гальваническом элементе является анодом, а в другом (соединенном с другим металлом) катодом. Другими словами, в зависимости от ситуации он может окисляться или восстанавливаться. Какой электродный потенциал будет у металла?
В таких ситуациях работает правило:
потенциалы окислительных и восстановительных процессов имеют одинаковое численное значение и противоположны по знаку
Например, для цинка:

важно отметить, что в справочных таблицах стандартных электродных потенциалов принято отображать только процессы восстановления. Следовательно, если электрод, то значение ЭДС такое, что нужно взять из такой таблицы — участник окислительного процесса, найти в нем значение ЭДС для него, как для участника процесса восстановления, и поменять знак в обратном порядке.
Итак, в самом общем случае ЭДС гальванического элемента определяется по формуле:

Следует отметить, что
ЭДС электрохимической ячейки всегда положительный
Мы определяем ЭДС как гальванический элемент, состоящий из медных и цинковых электродов, погруженных в растворы их солей:

Для расчета мы будем использовать справочную таблицу стандартных электродных потенциалов металлов и формулу для расчета EDS, учитывая, что из двух значений потенциала, меньшее из них будет соответствовать процессам окисления на аноде, а большее одна будет соответствовать процессам восстановления на катоде.
Согласно таблице восстановительный потенциал цинка составляет -0,763 В. В этом процессе цинк окисляется, а значит, его окислительный потенциал составляет +0,763 В. Медь восстанавливается, ее потенциал составляет +0,337 В.

Ряд напряжений металлов. Что это такое и каково его значение
Если измерить значения потенциалов стандартных электродов металлов указанным выше способом и расположить их в порядке возрастания, то получится знаменитая серия напряжений металлов (термин не совсем правильный). Лучше всего назвать это серией стандартных электродных потенциалов металлов. У него много других названий — электрохимический ряд активности металлов, серия Бекетова. Помимо металлов он содержит единственный неметаллический водород. Надеюсь, причина теперь ясна.
Эта строка:
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Cu Hg Ag Pt Au
В чем значение этой серии?
Исходя из значений потенциалов стандартных электродов, можно предположить, насколько выражены определенные свойства соответствующих металлов:
1) Чем ниже значение потенциала, тем активнее металл. Следовательно, серия начинается с лития. Значение его потенциала E ° = -3,045 В. Это наименьшее значение среди всех остальных. Действительно, литий — очень активный металл. Он легко окисляется, и его трудно восстановить из иона.
2) Все металлы в этом ряду слева от водорода (т.е с отрицательным значением потенциала) вытесняют его из разбавленных кислот (таких как соляная, серная).

3) Каждый предыдущий металл в ряду вытесняет все последующие из растворов своих солей. Например:

Этот вывод можно подтвердить расчетами:

Но такая реакция невозможна:

И это тоже легко подтверждается расчетом ЭЦП предполагаемого окислительно-восстановительного процесса:

Полученное отрицательное значение EDS предполагает, что переход электронов от меди к железу невозможен.
4) Если построить гальванический элемент из металлов заданной серии, то его ЭДС будет тем больше, чем больше разница между стандартными потенциалами электродов этих металлов.
Например, какой окислительно-восстановительный процесс будет более эффективным: вытеснение железа из его соли магнием или цинком? Для ответа на этот вопрос необходимо рассчитать ЭЦП обоих процессов и сравнить полученные значения:

В обоих случаях ЭЦП положительный. Это означает, что процессы возможны. Однако взаимодействие сульфата железа (II) с магнием почти в 6 раз эффективнее цинка.

Закон сохранения энергии для цепи с током с источником ЭДС гальваническим элементом
Рассмотрим закон сохранения энергии в цепи с током для одной цепи на рис.2.
Рисунок 2. Схема с током и гальваническим элементом. Author24 — обмен документами для студентов онлайн.