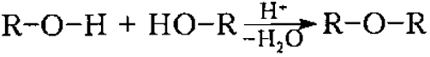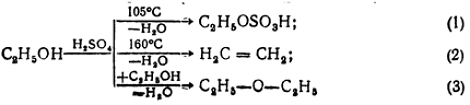- Одноатомные спирты: классификация
- Заменители кислот в процессе дегидратации кислот
- Реакции элиминирования (отщепления)
- Дегидратация
- Дегидрирование спиртов
- Структурная формула, классификация, изомерия, физические свойства
- Межмолекулярная дегидратация
- Химические свойства, реакции, с чем реагируют
- Химические свойства трехатомных спиртов (алкантриолей)
- ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
- Замещение атомов водорода гидроксильных групп
- Замещение гидроксильных групп
- Реакции окисления
- Горение
- Неполное окисление
- Фенол
- Физические свойства фенолов
- Химические свойства фенолов
Одноатомные спирты: классификация
Определение
Спирты представляют собой органические соединения с молекулами одной или нескольких гидроксильных групп, присоединенными к углеводородному радикалу.
Классификация спиртов по структурным характеристикам, т.е количеству гидроксильных групп в молекуле:
- одноатомный;
- двухатомный;
- трехатомный.
Определение
Одновалентные спирты или спирты представляют собой производные алканов, молекула которых имеет функциональную гидроксильную группу и связана с насыщенным атомом углерода.
Заменители кислот в процессе дегидратации кислот
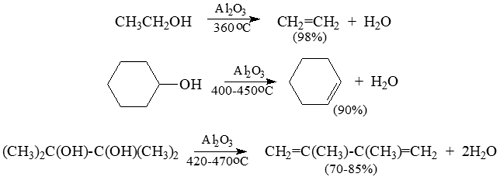
Для процессов дегидратации (как внутри-, так и межмолекулярной) спиртов, особенно в промышленных масштабах, вместо обычных кислот более удобно использовать безводные кислоты Льюиса или другие окислители, такие как оксид алюминия, в качестве дегидратирующих агентов. Процесс гетерогенно-каталитической дегидратации спиртов над $ Al_2O_3 $ до 350-450 $ ^ circ $ С приводит к алкенам:
Рисунок 9.
Реакции элиминирования (отщепления)
Дегидратация
Обезвоживание, что фактически означает удаление молекул воды, в случае спиртов отличается межмолекулярной дегидратацией и внутримолекулярной дегидратацией.
При межмолекулярной дегидратации спиртов молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (ROR):
Внутримолекулярная дегидратация спиртов происходит таким образом, что молекула воды отщепляется от молекулы спирта. Этот тип дегидратации требует несколько более строгих условий, состоящих из необходимости использования значительно более сильного нагрева, чем межмолекулярная дегидратация. В этом случае из молекулы спирта образуются молекула алкена и молекула воды:
Поскольку молекула метанола содержит только один атом углерода, внутримолекулярная дегидратация для нее невозможна. При дегидратации метанола может образоваться только эфир (CH3-O-CH3).
необходимо четко понимать тот факт, что в случае дегидратации асимметричных спиртов внутримолекулярное отщепление воды будет происходить по правилу Зайцева, т.е водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов нагреванием в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут к образованию кетонов:
в) Третичные спирты не вступают в подобную реакцию, т.е они не подвергаются дегидрированию.
Структурная формула, классификация, изомерия, физические свойства
Моновалентные спирты имеют группу -ОН.
Формула
Общая формула:
CnH2n + 1OH или CnH2n + 2O
В зависимости от типа углеводородного радикала дается следующая классификация спиртов:
- ограничить, например, CH3CH2CH2 — OH пропанол-1 (пропиловый спирт);
- ненасыщенный, например, CH2 = CH — CH2 — OH пропенол-2,1 (аллиловый спирт);
- ароматический, такой как C6H5-CH2-OH фенилметанол (бензиловый спирт).
Насыщенные одновалентные спирты объединены общей формулой:
CnH2n + 1 — ОН
Органические материалы, молекула которых содержит гидроксильные группы, имеют прямые связи с атомами углерода бензольного кольца. Такие вещества называются фенолами. Примером является C6H5-OH гидроксибензол (фенол).
В зависимости от количества углеводородных радикалов, которые принадлежат атому углерода к гидроксильной группе, различают следующие группы одновалентных спиртов:
- Первичные спирты, в которых группа ОН связана с первичным атомом углерода. Например, этанол СН3 — СН2 — ОН.
- Вторичные спирты, в которых группа ОН связана с вторичным атомом углерода. Например, пропанол-2: CH3 — CH (CH3) –OH.
- Третичные спирты, характеризующиеся сочетанием группы ОН и третичного атома углерода. Например, 2-метилпропанол-2: (CH3) 3C — OH.
- Метанол, который нельзя отнести к первичным, вторичным или третичным спиртам.
В случае ограничивающих веществ, которыми являются одновалентные спирты, изомерия характерна для простых эфиров в виде соединений с единой формулой R — O — R’.
Типы изомерии в химии, характерные для одновалентных спиртов:
- Структурная, когда положение ОН меняется от соединения, состоящего из трех атомов углерода. Примерами являются пропанол 1 (н-пропил) и пропанол-2 (изопропил).
- Изомерия углеродного звена при изменении расположения гидроксильной группы. Начните с веществ, молекула которых состоит из четырех атомов углерода. Например, бутанолу соответствуют 4 разных изомера.
- Межклассовая изомерия (с эфирами). Диметиловый эфир CH3 — O — CH3 соответствует этиловому спирту с формулой CH3CH2 — OH.
- Пространственная или зеркальная изомерия.
В том случае, если в спирте меньше пятнадцати атомов углерода, вещества имеют жидкое агрегатное состояние, резкий запах и хорошо испаряются. Если атомов углерода больше 15, вещества твердые. Метанол, этанол и попанол-2 характеризуются высокой степенью растворимости в водных средах. Вещества можно смешивать с водой в любом количестве.
Этим свойством не обладают спирты, у которых атомная масса и углеводородный радикал больше. Спирты характеризуются высокими температурами, при которых они кипят и плавятся. Можно сделать вывод, что в составе образуются водородные связи.
Первый член гомологической цепи (метанол) очень токсичен. С увеличением алкоголя температура, при которой вещество закипает, увеличивается. Каждый член основного ряда отличается при условиях кипения 20 ° C. Если размер и масса молекулы увеличиваются, вещество становится менее воспламеняющимся. Это самый простой способ зажечь метанол.
Соединения, которые имеют молекулу с девятью атомами углерода, способны растворяться в водной среде. Таким же свойством обладают поливалентные спирты. В этом случае для метанола или этанола концентрация может быть любой. Одновалентные спирты хорошо растворяются в таких веществах, как растворители.
Межмолекулярная дегидратация
Рассмотренные реакции являются примерами внутримолекулярной дегидратации, наряду с межмолекулярной дегидратацией, примером которой, как упоминалось выше, является образование эфира:
Рисунок 7.
Межмолекулярная дегидратация спиртов в присутствии концентрированных кислот в зависимости от температуры, соотношения объемов спирта и кислоты может происходить с образованием различных продуктов. Например, этиловый спирт при 105% ^ circ $ C образует с серной кислотой сложный эфир кислоты — этилсерной кислотой (реакция 1). При избытке спирта и высокой температуре (130-140 $ ^ circ $ C) происходит межмолекулярная дегидратация, основным продуктом которой является диэтиловый эфир (эфир; реакция 3). При температуре выше 160 $ ^ circ $ C этилсерная кислота разлагается с образованием этилена (реакция 2):
Рисунок 8.
Химические свойства, реакции, с чем реагируют
Реакция 1
Одновалентные спирты вступают в реакции горения:
C2H5OH + 3O2 → 2CO2 + 3H2O + Q
Реакция 2
Вещества проявляют кислотные свойства, реагируя с щелочными или щелочноземельными металлами:
2Na + 2H — O — H → 2NaOH + H2↑
2Na + 2R — O — H → 2RONa + H2↑
Примечание
Спирты не вступают в химические реакции со щелочами в твердом агрегатном состоянии и с растворами этих щелочей.
Реакция 3
Взаимодействие одновалентных спиртов и галогенидов водорода в концентрированной H2SO4:
C2H5OH + HBr → C2H5Br + H2O
Реакция 4
Спирты подвергаются внутримолекулярной дегидратации в присутствии концентрированной H2SO4. Если температура выше 140 ° C, синтезируются алкены.
C2H5OH → C2H4 + H2O
Реакция 5
Внутримолекулярная дегидратация спиртов возможна в среде с концентрированной H2SO4. При нагревании от 140 ° C и более эта реакция приводит к образованию простых эфиров.
2C2H5OH → C2H5OC2H5 + H2O
Реакция 6
Реакция окисления в условиях нагревания одновалентных спиртов протекает умеренно и приводит к образованию альдегидов.
CH3CH2OH + CuO → CH3 — CHO + Cu + H2O
Записанное уравнение называется качественной реакцией на вещества, являющиеся спиртами. При этом цвет осадка меняется с черного на розовый. Также присутствует специфический «фруктовый» аромат, характерный для альдегида.
Химические свойства трехатомных спиртов (алкантриолей)
Главный представитель — глицерин. Он содержится в жирах и липидах. Кислотные свойства алкантриолов превосходят таковые двухатомных спиртов.
Взаимодействие глицерина с азотной кислотой:
HO-CH2-CH (OH) -CH2-OH + HO-NO2 → NO2-O-CH2-CH (O-NO2) -CH2-O-NO2 + 3 H2O
В результате реакции образуется тринитрат глицерина — маслянистая жидкость с большой взрывной силой.
Спирты используются в органическом синтезе, в производстве биотоплива, растворителей, в качестве парфюмерного вещества в парфюмерии, в качестве основы в алкогольных напитках и т.д.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Поливалентные спирты, такие как одновалентные спирты, реагируют со щелочами, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); в этом случае в молекуле спирта может быть замещено другое количество атомов водорода гидроксильных групп:
2. Поскольку молекулы поливалентных спиртов содержат разные гидроксильные группы, они влияют друг на друга посредством отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О — Н и увеличению кислотных свойств гидроксильных групп.
Высокая кислотность поливалентных спиртов проявляется в том, что поливалентные спирты, в отличие от одновалентных спиртов, реагируют с некоторыми гидроксидами тяжелых металлов. Например, необходимо помнить, что свежеосажденный гидроксид меди реагирует с поливалентными спиртами с образованием ярко-синего комплексного раствора.
Таким образом, взаимодействие глицерина со свежеосажденным гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Эта реакция является качественной для поливалентных спиртов. Для сдачи экзамена достаточно знать признаки этой реакции, и совсем не обязательно уметь писать само уравнение взаимодействия.
3. Так же, как и одновалентные спирты, поливалентные спирты могут вступать в реакцию этерификации, т.е они реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Эта реакция катализируется сильными неорганическими кислотами и обратима. В связи с этим во время реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если карбоновые кислоты с большим количеством атомов углерода в углеводородном радикале, образующиеся в результате такой реакции, вступают в реакцию с глицерином, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используется так называемая азотирующая смесь, представляющая собой смесь концентрированных азотной и серной кислот. Реакция проводится при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитратом глицерина, является взрывчатым веществом. Кроме того, 1% раствор этого вещества в спирте обладает мощным сосудорасширяющим действием, что используется по медицинским показаниям для предотвращения инсульта или сердечного приступа.
Замещение гидроксильных групп
Реакции этого типа протекают по механизму нуклеофильного замещения. Взаимодействия этого типа включают реакцию гликолей с галогенидами водорода.
Так, например, протекает реакция этиленгликоля с бромистоводородной кислотой с последующей заменой гидроксильных групп на атомы галогена:
Реакции окисления
Горение
Спирты легко вступают в реакции горения. При этом выделяется большое количество тепла:
2CH3-OH + 3O2 = 2CO2 + 4H2O + Q
Неполное окисление
Неполное окисление первичных спиртов может привести к образованию альдегидов и карбоновых кислот.
При неполном окислении вторичных спиртов могут образовываться только кетоны.
Неполное окисление спиртов возможно при воздействии на них различных окислителей, например кислорода воздуха в присутствии катализаторов (металлическая медь), перманганата калия, дихромата калия и т.д.
В этом случае альдегиды могут быть получены из первичных спиртов. Как видите, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании окислителей, таких как перманганат калия и дихромат калия в кислой среде, возможно более глубокое окисление спиртов, особенно карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты в этих условиях могут окисляться только до кетонов.
Фенол
Фенол представляет собой простейшее соединение класса фенолов, которое напрямую характеризуется связью функциональной группы -ОН с бензольным кольцом. Атом кислорода имеет неподеленную пару электронов, с помощью которых он проявляет положительный мезомерный эффект.
Физические свойства фенолов
Фенолы — это кристаллические вещества. Они плохо растворимы в холода и хорошо растворимы в горячей воде и водных растворах щелочей. У них специфический запах. Для способности образовывать водородные связи характерны высокие температуры плавления и кипения.
Химические свойства фенолов
Электронная плотность кислорода фенола уменьшается, а в ядре увеличивается из-за структуры соединения. Увеличивается полярность связи ОН и возможны реакции замещения атома водорода под действием щелочей.
I. Кислотные свойства
Кислотные свойства фенолов превосходят спирты. Но в отличие от них фенолы — слабые кислоты.
-
- Прохождение углекислого газа через фенольные солиC6H5-ONa + CO2 + H2O → C6H5-OH + NaHCO3
- Иностранное образованиеC6H5-OH + CH3-COCl → C6H5-O-CO-CH3 + HCl
II. Реакция галогенирования
Функциональная группа –OH является заместителем первого типа, поэтому она обогащена бензольным кольцом с электронной плотностью. Это означает, что заместители переходят в орто- и пара-положения по отношению к -ОН-группе.
III. Реакция нитрования
Когда фенол взаимодействует с азотной кислотой, образуется смесь орто- и паранитрофенолов.
А при взаимодействии фенола с азотирующей смесью образуется 2,4,6-тринитрофенол — это опасное взрывчатое вещество.
IV реакция прикрепления
Фенолы — ненасыщенные соединения, поэтому для них характерны реакции присоединения.
V. Качественные реакции
Качественной реакцией на фенолы является его взаимодействие с кислотами Льюиса. В результате получился пурпурный комплекс.
Фенолы широко используются при получении фенилформальдегидных смол, синтетических волокон, красителей и лекарств. Пикриновая кислота — опасное взрывчатое вещество.
- https://wika.tutoronline.ru/himiya/class/9/poluchenie-i-primenenie-odnoatomnyh-spirtov
- https://spravochnick.ru/himiya/spirty_prostye_efiry_tioly_i_sulfidy/degidrataciya_spirtov/
- https://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/harakternye-himicheskie-svojstva-spirtov-fenola
- https://bingoschool.ru/manual/xarakternyie-ximicheskie-svojstva-predelnyix-odnoatomnyix-i-mnogoatomnyix-spirtov-fenola/