Определение
Если вас интересует химическое равновесие, это состояние химической системы, в котором происходит одна или несколько химических реакций. В этом случае скорости прямой и обратной реакции равны.

Если система находится в химическом равновесии, показатели концентрации, температуры и других параметров постоянны и не изменяются во времени.
Смещение химического равновесия
Такие ученые, как Ле Шателье и Браун, подробно изучили химическое равновесие и то, как оно изменяется.

Главный принцип смещения — это воздействие на систему, то есть под прямым воздействием различных факторов оно может изменяться. Основные параметры, которые необходимо учитывать при смещении химического равновесия, — это концентрация веществ, их температура и давление.
Что мы узнали?
В химическом равновесии скорости в каждой паре реакций равны друг другу. Химическое равновесие, изучаемое в 9 классе, можно разделить на три типа: истинное, метастабильное (кажущееся), заторможенное (ложное). Впервые термодинамическую теорию химического равновесия сформулировал ученый Ле Шателье. На равновесие системы влияют только три фактора: давление, температура, концентрация исходного вещества.
Факторы влияния
Факторы, изменяющие химическое равновесие, были описаны еще в 1885 году.

Следовательно, при повышении температуры химическое равновесие стремится к абсорбционной (эндотермической) реакции, а при понижении — к выделительной (экзотермической) реакции.
Давление — это показатель, который следует учитывать при работе исключительно с газами. Если он увеличивается, химическое равновесие смещается к меньшему объему веществ, а если оно уменьшается, к большему объему.
Когда концентрация одного из исходных веществ увеличивается или когда продукты удаляются из реакционной смеси, химическое равновесие смещается в сторону продуктов реакции и наоборот.
Несмотря на то, что многие химические реакции требуют использования катализаторов, эти вещества не влияют на смещение химического равновесия.
Смещение химического равновесия под действием различных факторов
Ученые говорили о подвижности равновесия еще в 19 веке. В то же время активно велись исследования, подтверждающие их гипотезы. Анри Ле Шателье был первым, кто попытался рассказать об этом в своих произведениях. Впоследствии его исследования резюмировал Карл Браун. Принцип Ле Шателье гласит:
Если на систему, находящуюся в равновесии, оказывается влияние, то равновесие смещается в том направлении, которое ослабляет это влияние
Влияние температуры
В обратимых реакциях обратная и обратная стороны процесса имеют противоположные температуры друг другу. В зависимости от температурного коэффициента реакции делятся на экзотермические (температура сбрасывается во время реакции). При повышении температуры в такой системе равновесие смещается в сторону обратной реакции.
S + O2 = SO2 + Q
Эндотермические реакции (которые происходят при нагревании), наоборот, если такая реакция нагрета, прямая реакция будет протекать быстрее.
CaCO3 = CO2 + CaO — Q
Это означает, что если впереди идет индикатор + Q-экзотермический процесс, то в противоположной стороне будет -Q — эндотермический процесс. Если температура исходных продуктов повышается, химическое равновесие смещается в том направлении, в котором наблюдается самая низкая температура.
Влияние концентрации
Согласно принципу Ле Шателье, увеличение концентрации реагентов вызывает смещение равновесия в сторону их расхода в прямом процессе. А если концентрация веществ снижается, химический баланс уменьшается в сторону противоположных процессов.
Тот же принцип применяется к увеличению концентрации продуктов реакции. Химическое равновесие смещается в сторону расходования реагентов, то есть в сторону обратной реакции. Если концентрация продуктов снижается, равновесие смещается в сторону прямого процесса.
Влияние давления
Давление не меняет баланса во всех процессах. Это происходит в реакциях с газообразными продуктами. Сумма коэффициентов прямой и обратной реакции должна быть неравной.
Важно! На состояние равновесия процессов с твердыми телами давление не влияет.
При разных концентрациях газообразных веществ слева и справа от реакции повышение давления приведет к сдвигу химического равновесия. Он движется в том направлении, в котором количество газообразных веществ уменьшается, а давление увеличивается.
Влияние катализатора
Большинство химических реакций происходит под действием катализаторов. Это специальные добавки в виде соединений и комплексов, ускоряющие процесс образования продукта. Их добавление никак не меняет химический баланс. В некоторых процесс помогает быстро сбалансировать детали.
Таблица химического баланса
| Т |
|
| р |
|
| с участием |
|
| катализатор | Не влияет |
Легенда:
- Т-температура,
- p-давление,
- c-концентрация,
- ↑ -увеличение,
- — снижаться.
Смотрите также:
- Классификация химических реакций в неорганической и органической химии
- Тепловой эффект химической реакции. Термохимические уравнения
- Скорость химической реакции, ее зависимость от различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Ионообменные реакции
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Редокс-реакции. Коррозия металлов и методы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Механизмы ионной реакции (правило В.В. Марковникова) и радикалы в органической химии
Смещение равновесия в химических реакциях
Химическое равновесие зависит от трех параметров: температуры, давления, концентрации вещества. Французский химик Анри Луи Ле Шателье в 1884 году сформулировал принцип динамического равновесия, согласно которому система равновесия под внешним воздействием стремится вернуться в состояние равновесия. То есть при внешнем воздействии баланс сместится таким образом, чтобы это воздействие нивелировалось.

Рис. 1. Анри Луи Ле Шателье.
Принципы, сформулированные Ле Шателье, также называют принципами «смещения равновесия в химических реакциях».
На химический баланс влияют следующие факторы:
- температура. При повышении температуры химическое равновесие смещается в сторону поглощения реакции. Если температура падает, равновесие смещается в сторону отделения реакции.

Рис. 2. Влияние колебаний температуры на химическое равновесие.
Реакция абсорбции называется эндотермической реакцией, а реакция высвобождения — экзотермической.
- давление. Если давление в химической реакции увеличивается, химическое равновесие смещается в сторону меньшего объема вещества. Если давление уменьшается, равновесие смещается в сторону большего объема вещества. Этот принцип применим только к газам, а не к твердым веществам.
- концентрация. Если в ходе химической реакции концентрация одного из веществ увеличивается, то равновесие смещается в сторону продуктов реакции, а если концентрация уменьшается, то равновесие смещается в сторону исходных веществ.
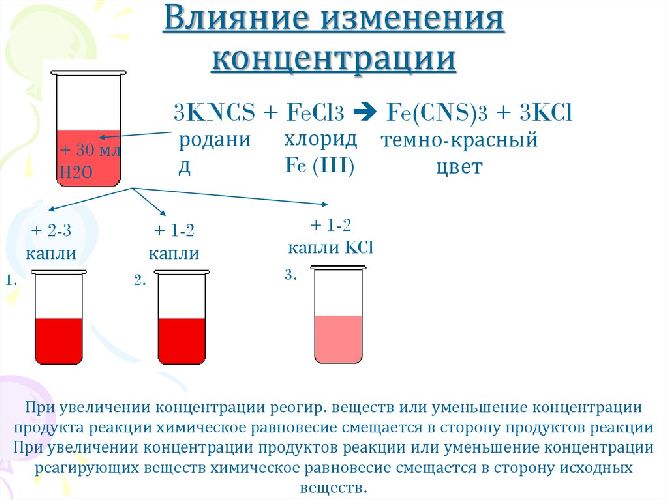
Рис. 3. Влияние изменения концентрации на химическое равновесие.
Катализатор не относится к факторам, влияющим на смещение химического равновесия.
